Η Ελαιοευρωπαΐνη και ο Ρόλος της στην Λειτουργία του Οργανισμού στην Πρόληψη και Θεραπεία: ο Μηχανισμός Απορρόφησης και Δράσης
1. Εισαγωγή
2. 2. Η Χημεία, συναφείς ενώσεις και η βιοσύνθεση της ελαιοευρωπαΐνηςς
2.1 Η χημεία της ελαιοευρωπαΐνηςς
2.2 Η βιοσύνθεση της ελαιοευρωπαΐνηςς
2.3 Ενώσεις που σχετίζονται με την ελαιοευρωπαΐνη στην ελιά
2.4 Η βιοδιαθεσιμότητα της ελαιοευρωπαΐνηςς
2.5 Η βιοπροσβασιμότητα και βιοδιαθεσιμότητα των μικρών ενώσεων του
ελαιόλαδου
3. H ελαιοευρωπαΐνη ως αντιοξειδωτικό
3.1 Οι επιδράσεις της ελαιοευρωπαΐνηςστην μη αλκοολική λιπώδης ηπατική νόσος
(NAFLD)
3.2 Η ελαιοευρωπαΐνη ως επαγωγέας αυτοφαγίας
3.3 Η ελαιοευρωπαΐνη και οι νευροεκφυλιστικές νόσοι (NDDs)
3.4 Η ελαιοευρωπαΐνη και η καρδιοπροστασία
3.5 Η ελαιοευρωπαΐνη ως αντι-αμυλοειδές εργαλείο
3.6 Οι επιδράσεις της ελαιοευρωπαΐνηςστην παχυσαρκία
3.7 Οι αντιδιαβητικές επιδράσεις της ελαιοευρωπαΐνηςς
3.8 Οι επιδράσεις της ελαιοευρωπαΐνηςστη δυσλιπιδαιμία
3.9 Οι αντι-αθερογόνες επιδράσεις της ελαιοευρωπαΐνηςς
3.10 Οι αντιυπερτασικές επιδράσεις της ελαιοευρωπαΐνηςς
3.11 Οι αντιφλεγμονώδεις επιδράσεις της ελαιοευρωπαΐνηςς
4. Επιπτώσεις στην υγεία των φαινολικών ενώσεων που βρίσκονται στο εξαιρετικό
παρθένο ελαιόλαδο (EVOO)
4.1 Επιπτώσεις του ελαιολάδου και των παραγώγων του στη σύνθεση του
μικροβιώματος του εντέρου
4.3 Οι επιπτώσεις στην υγεία των φαινολικών ενώσεων που υπάρχουν στα
εκχυλίσματα φύλλων ελιάς και ελαιοευρωπαΐνης
5. Βιβλιογραφία
1. Εισαγωγή
Στην ανασκόπηση της διεθνούς βιβλιογραφίας από τους Chiara Nediani, και συνεργάτες με τίτλο [1]: «Ελαιοευρωπαΐνη, μια βιοενεργητική ουσία από την Ole europaea L., ως δυνητικός παράγοντας στην θεραπεία των μη μεταδιδόμενων ασθενειών», αναλύοντας της μελέτες των World Health Organization … Menendez J.A., και συνεργατών [2-28], οι συντάκτες της μελέτης της περιγράφουν: «Η μεγάλη πρόοδος της ιατρικής έρευνας έχει συμβάλει σημαντικά στη μείωση της θνησιμότητας λόγω σοβαρών παθολογιών. Αλλά, από την άλλη πλευρά, ένα μεγαλύτερο προσδόκιμο ζωής έχει συσχετιστεί με μεγαλύτερη συχνότητα εμφάνισης ασθενειών και αναπηρίας.
Οι μη μεταδοτικές ασθένειες (ΜΔΑ) είναι μια ομάδα μακροχρόνιων και αργά προοδευτικών χρόνιων διαταραχών [2].
Ο Παγκόσμιος Οργανισμός Υγείας (ΠΟΥ) ανέφερε πρόσφατα ότι οι ΜΔΑ είναι οι κύριες αιτίες θανάτου και αναπηρίας για το γενικό πληθυσμό, ανεξάρτητα από την ηλικία, την περιοχή ή το φύλο [3]. Οι NCD έχουν μελετηθεί σε βάθος και έχουν εντοπιστεί ορισμένα κοινά βασικά χαρακτηριστικά.
Στα κοινά βασικά χαρακτηριστικά περιλαμβάνοντα:
- Η ενδοκυτταρική παρουσία οξειδωτικού στρες λόγω της ανώμαλης παραγωγής αντιδραστικών οξειδωτικών ειδών (ROS),
- Η ανεπαρκή αντιοξειδωτική άμυνα
- Η δυσρύθμιση της οδού της αυτοφαγίας, που είναι κύρια υπεύθυνη για τη διατήρηση της κυτταρικής πρωτεόστασης [4].
- Η φλεγμονή εμπλέκεται στις ΜΔΑ [5], δεδομένου ότι το επίπεδό της φλεγμονής σε έναν οργανισμό συνδέεται στενά με την κυτταρική redox και την αυτοφαγική κατάσταση [6, 7].
Το κόστος της υγειονομικής περίθαλψης που συνδέεται με τα ΜΔΑ τονίζει τη σημασία της εξεύρεσης νέων θεραπειών για αυτές τις παθολογικές καταστάσεις, και έχει αποδειχθεί ότι τα υγιή και ισολογημένα διατροφικά πρότυπα είναι χρήσιμα για την πρόληψη των ΜΔΑ [8].
Η κατανάλωση εξαιρετικά παρθένου ελαιολάδου (EVOO) είναι κοινή στη Μεσογειακή Διατροφή, η οποία είναι σε μεγάλο βαθμό γνωστό ότι έχει πολλά οφέλη για την υγεία και μπορεί να αυξήσει τη μακροζωία, όπως αναφέρθηκε από τον Εκπαιδευτικό Επιστημονικό και Πολιτιστικό Οργανισμό των Ηνωμένων Εθνών (UNESCO) το 2010 [9, 10].
Όπως αναφέρθηκε πρόσφατα στην III Διεθνή Διάσκεψη για το Παρθένο Ελαιόλαδο και την Υγεία Έκθεση Συναίνεσης, EVOO η πρόσληψη συνδέεται επίσης με μειωμένο κίνδυνο των περισσότερων ασθενειών που σχετίζονται με τη γήρανση, συμπεριλαμβανομένων των καρδιαγγειακών και νευροεκφυλιστικών ασθενειών (CVD και NDD), και ορισμένα είδη καρκίνου [11].
Αρχικά, οι ευεργετικές ιδιότητες του EVOO αποδόθηκαν στα λειτουργικά συστατικά όπως μονοακόρεστα και πολυακόρεστα λιπαρά οξέα (MUFA και PUFA), όπως ελαϊκό οξύ (55 έως 83% του συνολικού λιπαρών οξέων (FA)), το βασικό FA, λινολικό οξύ (3 έως 21% του συνολικού FA), και λινελαιοευρωπαΐνηνικό οξύ (0 έως 1,5% του συνολικού FA).
Ωστόσο, πρόσφατες επιδημιολογικές και πειραματικές μελέτες δείχνουν επίσης ότι οι μικρές βιοδραστικές ενώσεις, συμπεριλαμβανομένων των φαινολικών αλκοολών, όπως υδροξυτυροσόλη (HT, 3,4-διυδροξυφαινυλαιθανόλη, 3,4-DHPEA) και τυροσόλη (p-υδροξυφαινυλαιθανόλη, p-HPEA), secoilidoid παράγωγα, φαινολικά οξέα, λιγνάνες και φλαβονοειδή συμβάλλουν στις ευεργετικές επιδράσεις του EVOO [12, 13, 14, 15].
Η υψηλή περιεκτικότητα σε βιοφαινόλες προσδίδει υψηλή σταθερότητα στους EVOO, εμποδίζοντας την αυτοξίωση του EVOO και συμβάλλοντας σε μια μακρά διάρκεια ζωής.
Η ελαιοευρωπαΐνη (Ole) είναι η κύρια φαινολική ένωση της ελιάς, Ole europaea L., και είναι ιδιαίτερα άφθονη σε μη επεξεργασμένους καρπούς και φύλλα ελιάς, με συγκεντρώσεις έως 140mg*g−1 σε βάση ξηράς ύλης σε νεαρές ελιές [14] και 60–90 mg*g−1 ξηράς ουσίας στα φύλλα [16].
Στην Ole europaea, Ole, η demethyloleuropein, ligstroside, and oleoside 11-methyl ester είναι άφθονα secoiridoids [17] ενώ η verbascoside [18] είναι το κύριο υδροξυκινναμικό παράγωγο των ελιών [19]
Η ελαιοευρωπαΐνη (Ole) ανήκει στα secoilidoids, τα οποία είναι άφθονα σε Oleceas, Gentianales Cornales, καθώς και πολλά άλλα φυτά. Ιριδοειδή και secoiridoids είναι ενώσεις που είναι συνήθως γλυκοσιδικά δεσμευτικά, και παράγονται από το δευτερογενές μεταβολισμό των τερπενίων, ως πρόδρομες ουσίες των διαφόρων ινδολών αλκαλοειδών.
Τα secoilidoids στο Oleceae προέρχονται συνήθως από τον τύπο ελαιοσιθών γλυκοσιδών (ελαιοσιίδες), τα οποία χαρακτηρίζονται από εξωκυκλική λειτουργία 8,9-ελαιοευρωπαΐνηφινικής λειτουργίας, σε συνδυασμό του ελενολικού οξέος και του γλυκοσιδικού υπελαιοευρωπαΐνηίμματος [16]. Η Ole είναι εστέρας του ελενολικού οξέος και του HT και έχει ελαιοσιδικό σκελετό που είναι κοινός στις γλυκοσίδειες του Oleceae (Εικ. 1).
Η Ole είναι παρούσα στις πράσινες ελιές, κατά τη διάρκεια της μηχανικής διαδικασίας εκχύλισης λαδιού, υδρολύεται από τη δραστηριότητα των ενδογενών β-γλυκοσιδάσεων για να σχηματίσουν ελαιοευρωπαΐνη αγλυκόνη (Ole), υπεύθυνη για την πικρή και πικάντικη γεύση του EVOO.
Η Ole μαζί με άλλα παράγωγα είδη secoiridoid, όπως , the dialdehydic derivative of decarboxymethyl elenolic acid bound to either HT (3,4-dihydroxyphenylethanol-elenolic acid dialdehyde, 3,4-DHPEA-EDA, Olecein), or to tyrosol (p-hydroxyphenylethanol-elenolic acid dialdehyde, p-HPEA-EDA, oleocanthal), and ligstroside aglycone (p-HPEAEA), αντιπροσωπεύει τις δευτερεύουσες πολικές ενώσεις που καθορίζουν την αντιοξειδωτική ικανότητα του EVOO.
Τα τελευταία χρόνια, η ελαιοευρωπαΐνη και τα παράγωγά της έχουν προσελκύσει το ενδιαφέρον της επιστημονικής κοινότητας [20] λόγω των αντι-φλεγμονωδών τους επιδράσεων.
Εικόνα 1 Η χημική μορφή της ελαιοευρωπαΐνης

Η πρώτη μελέτη οφειλόταν στην παρόμοια δομή της με την ιβουπροφαίνη [21], η δεύτερη για την ικανότητά της να διεγείρει την έκφραση του CD163, της αντιφλεγμονώδους γονιδίου [22, 23].
Η σημασία των βιοδραστικών συστατικών στο EVOO ενισχύθηκε από την Ευρωπαϊκή Αρχή για την Ασφάλεια των Τροφίμων (EFSA), η οποία το 2011 εξέδωσε ισχυρισμό υγείας [24, 25] σχετικά με την αποτελεσματικότητα των φαινολών του λαδιού ελιάς (5mg/ημέρα ανά 20 g EVOO, HT και Ole) για την προστασία της LDL από την οξείδωση, το αρχικό συμβάν του σχηματισμού αθηροματικής πλάκας.
Αυτό παρουσιάζει ενδιαφέρον, διότι είναι μοναδικό ως ισχυρισμός υγείας που συσχετίζει μια συγκεκριμένη δοσολογία του φυσικού βιοδραστικού συστατικού των τροφίμων με μείωση του καρδιαγγειακού κίνδυνου (οξείδωση της LDL χοληστερόλης) [26].
Τα φύλλα της ελιάς είναι ένα μεσογειακό φυτικό φάρμακο, που χρησιμοποιείται ως παραδοσιακό φάρμακο για την προώθηση της υγείας και μια θεραπεία για χρόνιες παθήσεις. Οι διαφορές στην περιεκτικότητα σε Ole εξαρτώνται από την ποικιλία, την περιοχή παραγωγής και της συνθήκες ιστού των φύλλων (νωπές, κατεψυγμένες, αποξηραμένες ή λυοφιλοποιημένες).
Τα εμπορικά εκχυλίσματα φύλλων Ole, τυποποιημένα σε περιεκτικότητα σε Ole, χρησιμοποιήθηκαν για την απόκτηση συμπληρωμάτων διατροφής με συγκεκριμένες βιολογικές και βιοϊατρικές ιδιότητες [27].
Πρόσφατα, η ελαιοευρωπαΐνη, έχει προσελκύσει την επιστημονική προσοχή λόγω των οφελών για την υγεία, τις αντιοξειδωτικές, αντιφλεγμονώδη, καρδιο- και νευροπροστατευτικές ιδιότητες κ.α..
Αυτές οι φαρμακολογικές δραστηριότητες οφείλονται κυρίως στα υποτιθέμενα χαρακτηριστικά καθαρισμού ελευθέρων ριζών. Μηχανιστικές μελέτες δείχνουν ότι αυτές οι ενώσεις είναι σε θέση να δράσουν σε διαφορετικά σημεία, παρεμβαίνοντας με τη λειτουργία των πρωτεϊνών και την έκφραση γονιδίων, ή τροποποιώντας κυτταρικές οδούς που σχετίζονται με της παθολογικές διεργασίες ΜΔΑ [26, 28], γεγονός που υποδηλώνει ότι οι ενέργειες της ελαιοευρωπαΐνηςσε διάφορες διαταραχές μπορεί να προκύψουν από κοινούς μοριακούς μηχανισμούς. Όπως αναφέρθηκε παραπάνω, δυσρυθμισμένη αυτοφαγία είναι ένα κοινό χαρακτηριστικό των ΜΔΑ.
Αυτή η δυσρύθμιση φαίνεται να οφείλεται σε αυξημένο οξειδωτικό στρες. Πρόσφατα στοιχεία υποδεικνύουν αλληλεπίδραση μεταξύ της αυτοφαγίας και οξειδωτικού στρες που επηρεάζει τη φλεγμονώδη κατάσταση των ιστών, που συνδέονται με την ανάπτυξη ΜΔΑ [4] (Εικ. 2).
Εικ. 2 Επίδραση της ελαιοευρωπαΐνηςστην αλληλεπίδραση μεταξύ του οξειδωτικού στρες, της αυτοφαγίας και της φλεγμονής σε μη μεταδοτικές ασθένειες

Εικ. 2 Επίδραση της ελαιοευρωπαΐνηςστην αλληλεπίδραση μεταξύ του οξειδωτικού στρες, της αυτοφαγίας και της φλεγμονής σε μη μεταδοτικές ασθένειες. AMPK, 5’ adenosine monophosphate-activated protein kinase; Beclin-1 autophagy-specific marker; COX, Cyclooxygenase; CRP, C Reactive Protein; Hcy, homocysteine; ICAM-1, Intercellular Adhesion Molecule 1; IL-1β, interleukin-1β; IL-6, interleukin-6; iNOS, inducible form of nitric oxide synthase; LC3 autophagy-specific marker; MMP-9, metalloproteinases-9; mTOR, mammalian target of rapamycin; NF-kB, Nuclear Factor Kappa-Light-Chain-Enhancer of Activated B Cells; oxLDL, oxidized low-density lipoprotein; p62 autophagy-specific marker; PARP1, Poly (ADP-ribose) polymerase; ROS, Reactive Oxygen Species; SIRT-1, NAD-dependent deacetylase sirtuin-1; TFEB, Transcription factor EB; TNF-α, tumour necrosis factor-α; VCAM-1, Vascular Cell Adhesion Molecule 1.
2. Η Χημεία, συναφείς ενώσεις και η βιοσύνθεση της ελαιοευρωπαΐνηςς
2.1 Η χημεία της ελαιοευρωπαΐνηςς
Στην μελέτη ανασκόπησης της διεθνούς βιβλιογραφίας από της Javed Ahamad και συνεργάτες [29] με τίτλο: «Ελαιοευρωπαΐνη: Ένα φυσικό αντιοξειδωτικό μόριο για την αγωγή του μεταβολικού συνδρόμου», αναλύοντας της μελέτες των Cecchi, L., και συνεργατών … Paiva-Martins, F., & Gordon, M. H. [30-42], οι συντάκτες της μελέτης της περιγράφουν: «Η ελαιοευρωπαΐνη είναι ένα secoiridoid που λαμβάνεται κυρίως από μη επεξεργασμένους καρπούς ελιάς και φύλλα ελιάς. Η ελαιοευρωπαΐνη είναι ένα σύνθετο μόριο που αποτελείται από τρεις δομικές υπομονάδες: μια πολυφαινόλη (υδροξυτυροσόλη), ένα secoiridoidoid (ελενολικό οξύ) και ένα μόριο γλυκόζης με μοριακό βάρος 540,51g/mol (εικόνα 1).
Τα κύρια βιοδραστικά συστατικά της ελιάς είναι η ελαιοευρωπαΐνη ligstroside, nuzhenide, nuzhenide oleoside, and demethyloleuropein [30]. Τα άλλα δευτερεύοντα συστατικά της ελιάς είναι τυροσόλη, υδροξυτυροσόλη, και συναφείς ενώσεις.
Η ελαιοευρωπαΐνη (1) απομονώθηκε και χαρακτηρίστηκε ως secoiridoid από τον Panizzi το 1960. Η απόλυτη διαμόρφωση των chiral κέντρων του secoilidoid oleuropein καθορίστηκε από τους Inouye και συνεργάτες το 1970 [31].
Η περιεκτικότητα της ελαιοευρωπαΐνηςστους καρπούς της ελιάς ποικίλλει ανάλογα με τα στάδια ανάπτυξης [30]. Η ανάπτυξη των καρπών ελιάς χωρίζεται σε τρεις φάσεις. Η πρώτη είναι φάση ανάπτυξης κατά την οποία εμφανίζεται συσσώρευση της ελαιοευρωπαΐνηςς. Δεύτερη φάση είναι η φάση της πράσινης ωρίμανσης στην οποία παρατηρείται μείωση της περιεκτικότητας σε ελαιοευρωπαΐνη. Η Τρίτη φάση είναι μαύρη φάση της ωρίμανσης κατά τη διάρκεια της οποίας το επίπεδο της ελαιοευρωπαΐνηςείναι πολύ χαμηλά [31-35] (Εικ. 3).
2.2 Η βιοσύνθεση της ελαιοευρωπαΐνηςς
Η βιοσύνθεση της ελαιοευρωπαΐνηςστην Oleceae ακολουθεί την οδό μεβαλονικού οξέος (mevalonic acid). Οι Damtoft, και συνεργάτες [36] πρότειναν τη βιοσύνθεση της ελαιοευρωπαΐνηςστην οικογένεια Oleceae. Σύμφωνα με τον ίδιο, διακλάδωση στην οδό του μεβαλονικού οξέως οδηγεί σε βιοσύνθεση της γερανιόλης, 10-υδροξυγκερανοΐδη, 10-υδροξυνεόλη, και ιριδοειδής.
Από iridoidal, loganin βιοσυντήθενται, και αργότερα δεοξυολογανικό οξύ, 7-επιολογιακό οξύ, και λογολικό οξύ ενσωματώνονται στην ligustroside. Η ligustroside θεωρείται άμεσος πρόδρομος της ελαιοευρωπαΐνηςς, μέσω 7-κετολογανικού οξέος ως ενδιάμεσου προϊόντος.
Μια πιθανή βιοσυνθετική οδός από το from deoxyloganic acid, 7-epiloganic acid, 7-ketologanic acid, 8-epikingisidic acid, oleoside 11-methyl ester, 7-β-1-D-glucopyranosyl 11-methyl oleoside, and ligustroside προτάθηκε από τον S. Damtoft et al. [36].
Εικ. 3 Η βιοσύνθεση της ελαιοευρωπαΐνης στην ελιά

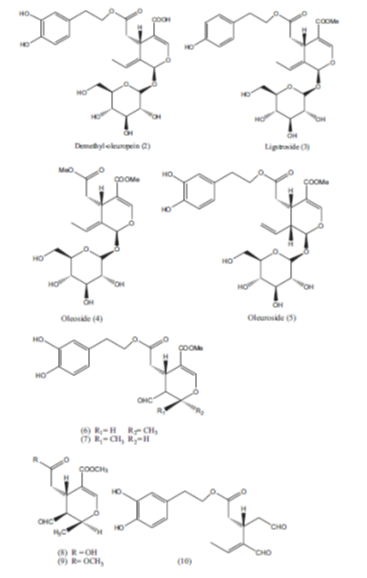
2.3 Ενώσεις που σχετίζονται με την ελαιοευρωπαΐνη στην ελιά
Αρκετές δευτερεύουσες ενώσεις που σχετίζονται με την ελαιοευρωπαΐνη και απομονώνεται από την ελιά συνοψίζονται στο εικόνα 4. Η ελαιοευρωπαΐνη είναι μεθυλεστέρας της διμέθυλοελαιοευρωπαΐνης.
Η διμέθυλοελαιοευρωπαΐνη είναι μια μικρή ένωση μόνο σε άγουρες ελιές, ενώ, σε ορισμένες ποικιλίες, σε ώριμες ελιές, η περιεκτικότητα σε διμέθυλοελαιοευρωπαΐνη γίνεται μεγαλύτερη από την ελαιοευρωπαΐνη [30]. Ligstroside (3), διαφέρουν από την ελαιοευρωπαΐνη μόνο για την παρουσία μιας μονάδας τυροσόλης αντί του υδροξυ-τυροσόλου [37].
Η Oleoside (4), είναι διμεθυλοεστέρας της ελαιοευρωπαΐνηςστην οποία η μεθυλοαλκοόλη αντικαθιστά την υδροξυτυροσόλη στην εστεροποίηση της ομάδας καρβοξυλίου στο C-7 της. Oleuroside (5) διαφέρει από την ελαιοευρωπαΐνη στη μετατόπιση του διπλού δεσμού C-8/C-9 στη θέση C-8/C-10 στην ελαιούσια [38].
Ενώσεις (6) και (7) είναι μη γλοιοσιδικά ιριδοειδή που ίσως προκύπτουν από την υδρόλυση της γλυκοσιδικής ομάδας της Oleuroside με επακόλουθη αναδιάταξη της αγλυκόνης [39].
Δύο άλλα nonglycosidic secoiridoids είναι το ελενολικό οξύ (8) [40] και ο μεθυλοεστέρας του, ο οποίος συντέθηκε αρχικά από MacKellar, και συνεργάτες [41]. Η ο-διφαινολική-ένωση-10 ελήφθη από ώριμες μαύρες ελιές από της Scalzo και Scarpati (1993) και διαδοχικά από της Paiva-Martins και Gordon [42].
Εικ. 4 Ενώσεις που σχετίζονται με την ελαιοευρωπαΐνη στην ελιά
2.4 Η βιοδιαθεσιμότητα της ελαιοευρωπαΐνηςς
Στην ανασκόπηση της διεθνούς βιβλιογραφίας από της Chiara Nediani, και συνεργάτες με τίτλο [1]: «Ελαιοευρωπαΐνη, μια βιοενεργητική ουσία από την Ole europaea L., ως δυνητικός παράγοντας στην θεραπεία των μη μεταδιδόμενων ασθενειών», αναλύοντας τις μελέτες των Savournin C., και συνεργατών … Mosele J.I., και συνεργατών [43-58], οι συντάκτες της μελέτης περιγράφουν: «Τα ευεργετικά αποτελέσματα των φύλλων ελιάς ή διαφορετικών παρασκευασμάτων (π.χ. εγχύσεις, εκχυλίσματα) είναι γνωστά από την αρχαιότητα και έχουν χρησιμοποιηθεί ως παραδοσιακά βότανα για τη θεραπεία πολλών ασθενειών (του σακχαρώδη διαβήτη, αρθρικής υπέρτασης και βρογχικού άσθματος) ή για την ανακούφιση των συμπτωμάτων τους.
Τα φύλλα ελιάς μπορούν να αποτελέσουν καλή πηγή για την ανάπτυξη νέων δυνητικά λειτουργικών τροφίμων που μπορούν να συμβάλουν, μέσω της βασικής διατροφής, της βέλτιστες συνθήκες υγείας μειώνοντας τον κίνδυνο των ΜΜΑ.
Η ελαιοευρωπαΐνη Ole είναι το κύριο συστατικό της οικογένειας secoiridoid στα φύλλα ελιάς. Η υδροξυτυροσόλη (HT) είναι ο κύριος μεταβολίτης του Ole/Ole, αλλά διαθέτει της την μεγαλύτερη αντιοξειδωτική ικανότητα. Αν και αυτό το χαρακτηριστικό αυξάνει τη σημασία της HT, η απόκτηση της σε συνθετική μορφή είναι δαπανηρή, έτσι έχουν αναπτυχθεί μέθοδοι που χρησιμοποιούν το Ole ως πηγή παραγωγής της HT [43, 44, 45].
Η πιθανότητα αυτών των βιοφαινολών να ασκήσουν τις βιολογικές τους επιδράσεις εξαρτάται από την πιθανότητα επίτευξης των βασικών μοριακών στόχων στους ανθρώπινους ιστούς σε επαρκή δόση, η οποία εξαρτάται από το μεταβολισμό και τη βιοδιαθεσιμότητα τους.
Ωστόσο, τα δεδομένα σχετικά με το μεταβολισμό της ελαιοευρωπαΐνης από evoo ή φύλλα ελιάς στον άνθρωπο είναι φτωχά, και συχνά τα αποτελέσματα στο επίπεδο και τη μορφή που βρέθηκαν στο πλάσμα, και / ή απεκκρίνεται στα ούρα, είναι αντικρουόμενες [46, 47, 48].
Αυτή η διαφορά μπορεί να εξηγηθεί από το γεγονός ότι η βιοδιαθεσιμότητα της Ole επηρεάζεται από διάφορους παράγοντες, όπως η οδός χορήγησης, ο γονότυπος, η ηλικία, το φύλο, η αλληλεπίδραση με τα τρόφιμα, καθώς και από της διάφορες διαδικασίες εκχύλισης και τις αναλυτικές μεθόδους που χρησιμοποιούνται [49].
Μια πρόσφατη ανθρώπινη δοκιμή έδειξε ότι η από του στόματος κατάποση Ole είναι ανθεκτική στις όξινες συνθήκες του στομάχου, και απορροφάται γρήγορα (55-60%) στον εντερικό σωλήνα, φθάνοντας σε μέγιστη συγκέντρωση στο πλάσμα (23–30 λεπτά, ανάλογα με το παρασκεύασμα, υγρό έναντι κάψουλας αντίστοιχα) νωρίτερα από τους συζευγμένους μεταβολίτες της HT, γλυκουρονιωμένη και θειική (σε 64–93 λεπτά), που αποτελούν το 96-99% των φαινολικών μεταβολιτών Ole που ανιχνεύθηκαν στο πλάσμα και τα ούρα μετά την πρόσληψη [50].
Αυτά τα δεδομένα υποδεικνύουν τον πιθανό πλήρη μεταβολισμό του Ole σε HT, και άλλα προϊόντα υποβάθμισης. Θα πρέπει να ελέγχεται η αποτελεσματικότητα in vivo αυτών των ενώσεων όσον αφορά την κινητική απορρόφησης και μεταβολισμού της μετά την κατάποση.
Στην πραγματικότητα, η κύρια κριτική των in vitro μελετών που χρησιμοποιούν αυτά τα μόρια είναι ότι οι δόσεις που χρησιμοποιούνται είναι σε μεγαλύτερες συγκεντρώσεις (μmol/L–mmol/L) σε σύγκριση με τις συγκεντρώσεις μεταβολίτη που μετρώνται στο πλάσμα, οι οποίες είναι μόνο στη συγκέντρωση nmol/L [51].
Ως εκ τούτου, έχουν αναπτυχθεί συστήματα παράδοσης με βάση την εστεροποίηση/λιπόφιλη και την ενθυλάκωση φαινολικών ενώσεων ή τη χρήση λιποσσωμάτων ή/και νανοσωματιδίων βιοδραστικών ενώσεων, για την αύξηση της βιοδιαθεσιμότητας και της βιοπροσφοράς της [52, 53, 54].
Πρόσφατα, έχει δοθεί μεγάλη προσοχή στο μικροβίωμα του εντέρου, το οποίο θεωρείται μεταβολικό ‘’όργανο’ που επηρεάζει τη διατροφή των ξενιστών, και μπορεί να επηρεάσει τη βιοδιαθεσιμότητα και βιοαπόδοση των φαινολικών ενώσεων ελιάς μέσω βιομετασχηματισμού σε δραστικές ουσίες, οι οποίες έχουν ενδιαφέρουσες ευεργετικές ιδιότητες για την υγεία έναντι των ασθενειών του εντέρου [55, 56, 57].
Mosele et al. [58], σε ένα in vitro πρότυπο πείραμα, παρατήρησε ότι Ole ήταν γρήγορα deglycosylated κατά τη διάρκεια 6 ωρών της επώασης με ανθρώπινο μικροβίωμα κοπράνων. Το τελευταίο αποικοδομήθηκε σε ελενολικό οξύ και HT από μικροβιακή εστεράση, έως ότου εξαφανίστηκε μετά από 48 ώρες.
Αντίθετα, η HT αυξανόταν συνεχώς κατά την ίδια περίοδο ζύμωσης. Το εύρημα αυτό επιβεβαιώθηκε από τους συντάκτες σε μια in vivo μελέτη, η οποία έδειξε ότι μετά την πρόσληψη ελαιολάδου πλούσιου σε φαινόλη για τρεις εβδομάδες, η συγκέντρωση της ελεύθερης HT αυξήθηκε σημαντικά στα κόπρανα όλων των συμμετεχόντων στη μελέτη».
2.5 Η βιοπροσβασιμότητα και βιοδιαθεσιμότητα των μικρών ενώσεων του ελαιόλαδου
Στην ανασκόπηση της διεθνούς βιβλιογραφίας από της Annalisa Romani, και συνεργάτες με τίτλο [59]: «Επιπτώσεις στην υγεία των φαινολικών ενώσεων που βρέθηκαν στο εξαιρετικό παρθένο ελαιόλαδο, υποπροϊόντα και φύλλα Ole europaea L.», αναλύοντας της μελέτες των Visioli F., και συνεργατών … Aponte M.,και συνεργατών [60-69], οι συντάκτες της μελέτης περιγράφουν: «Οι μικρές πολικές ενώσεις των προϊόντων, της HT, Tyr, και Ole έχουν διαφορετική βιοπροσβασιμό-τητα και βιοδιαθεσιμότητα. Μία από της πρώτες μελέτες σχετικά με τη βιοδιαθεσιμότητα των μικρών πολικών ενώσεων διεξήχθη από Visioli et al. Από το 2000, η οποία έδειξε ότι HT και Tyr απορροφώνται δοσοεξαρτώμενα [60].
Σε μια πρόσφατη ανασκόπηση, συλλέχθηκαν μελέτες σχετικά με τη βιοδιαθεσιμότητα των κύριων μικρών ενώσεων Ole—της ht, tyr και OLE—στο ελαιόλαδο [61]. Σε μια μελέτη του 2016, τα επίπεδα HT στο πλάσμα αξιολογήθηκαν μετά την κατάποση ελαιολάδου και EVOO. Τα φαρμακοκινητικά αποτελέσματα δείχνουν ότι δεν ήταν δυνατή η ανίχνευση ΗΤ στο αίμα μετά την κατάποση συνηθισμένου ελαιολάδου, σε αντίθεση με τα αποτελέσματα που ελήφθησαν μετά την κατάποση του EVOO [62].
Ανέφεραν πολλοί συγγραφείς ότι, η βιοπροσβασιμότητα αφορά την ποσότητα των συστατικών που (είναι) και απελευθερώνονται από τα τρόφιμα στο γαστρεντερικό (GI) σωλήνα, ενώ η βιοδιαθεσιμότητα είναι η ποσότητα της χωνευμένης(-ών) ένωσης(-ων) που απορροφάται και μεταβολίζεται μέσα στο ανθρώπινο σώμα.
Όσον αφορά την OLE, ορισμένοι συγγραφείς ανέφεραν ότι, υπό in vitro γαστρεντερικές παθήσεις, ήταν η πιο ανθεκτική ένωση μεταξύ εκείνων που υπάρχουν στα φύλλα ελιάς, μεταβάλλοντας την περιεκτικότητά της μεταξύ 26% και 61%, ανάλογα με τον τύπο του εκχυλίσματος κατά τη διάρκεια της πρώτης ώρας [63].
Οι ίδιοι συγγραφείς διαπίστωσαν ότι η εντερική φάση επηρέασε την OLE περισσότερο από το γαστρικό πιθανώς λόγω της παγκρεατικής ενζυμικής δραστηριότητας και του αλκαλικού pH συμβάλλοντας στη μείωση της βιοπροσβασιμότητας του, έτσι ώστε στο τέλος των διαδικασιών πέψης μόνο το 10% του OLE ήταν παρόντες.
Η βιοπροσβασιμότητα HT και OLE έχει διερευνηθεί in vitro από την Jilani H et al. [63] σε σχέση με την πιθανή χρήση του Saccharomyces cerevisiae ως νέου φορέα OLE ως μέσο για την προστασία της μόνιμης αντιοξειδωτικής της ικανότητας κατά τη διάρκεια της προσομοίωσης της γαστρεντερικής πέψης.
Στην πραγματικότητα, τα προηγούμενα αποτελέσματα έδειξαν την επίδραση της δόσης και της σύνθεσης που λαμβάνονται από τα άτομα, εκτός από το φύλο, τις συγκεντρώσεις στο πλάσμα. Στην ίδια μελέτη, οι συγγραφείς παρατήρησαν ότι, οι πρωτογενείς μεταβολίτες που εντοπίστηκαν στα ούρα και το πλάσμα ήταν οι συζευγμένες μεταβολίτες της HT, που αποτελούνται κυρίως από θειικές ΗΤ και γλυκουρονιωμένες ενώσεις [64].
Το μικροβίωμα του εντέρου είναι παράγοντας που μπορεί να επηρεάσει τη βιοδιαθεσιμότητα και τη βιοπροσβασιμότητα των φαινολικών ενώσεων ελιάς με την εκτέλεση βιομετασχηματισμού της, σε ενεργούς μεταβολίτες με ενδιαφέρουσες ευεργετικές ιδιότητες για την υγεία σε ασθένειες του εντέρου [65].
Χρησιμοποιώντας το ανθρώπινο μικροβίωμα των κοπράνων, ένα in vitro μοντέλο [66] παρατήρησε ότι το OLE απογλυκυλιώθηκε ταχέως μέχρι 6 ώρες επώασης που παράγουν ελαιοευρωπαΐνη Ole-αγλυκόνη, η οποία, από την άλλη πλευρά, αποικονιωνήθηκε σε ελενολικό οξύ και HT από μικροβιακή δραστηριότητα εστεράσης, έως ότου εξαφανίστηκε μετά από 48 ώρες.
Αντίθετα, η HT, ο κύριος μεταβολίτης της υδρόλυσης του εστέρα OLE αυξήθηκε συνεχώς κατά τη διάρκεια της περιόδου ζύμωσης. Οι ίδιοι συγγραφείς συνδύασαν τις in vitro μελέτες ζύμωσης του παχέος εντέρου με μια in vivo παρέμβαση και διαπίστωσαν, μετά από 3 εβδομάδες πρόσληψης ελαιόλαδου πλούσιου σε φαινόλη, σημαντική αύξηση της συγκέντρωσης της ελεύθερης HT στα κόπρανα όλων των συμμετεχόντων στη μελέτη, επιβεβαιώνοντας τα in vitro ευρήματα.
Είναι ενδιαφέρον ότι, ο Santos et al. [67] έδειξε ότι η μετατροπή της OLE σε HT πραγματοποιήθηκε από βακτήρια του γαλακτικού οξέος, ιδίως από Lactobacillus plantarum [68]».
3. Hελαιοευρωπαΐνη ως αντιοξειδωτικό
Στην ανασκόπηση της διεθνούς βιβλιογραφίας από της Chiara Nediani, και συνεργάτες με τίτλο [1]: «Ελαιοευρωπαΐνη, μια βιοενεργητική ουσία από την Ole europaea L., ως δυνητικός παράγοντας στην θεραπεία των μη μεταδιδόμενων ασθενειών», αναλύοντας της μελέτες των Visioli F., και συνεργατών … Mangione P.P., και συνεργατών [70-137], οι συντάκτες της μελέτης της περιγράφουν: «Οι ισχυρές αντιοξειδωτικές ιδιότητες της ελαιοευρωπαΐνης είναι γνωστές και μοιράζονται με της φαινόλες που υπάρχουν στα φύλλα ελιάς και στο ελαιόλαδο (βλέπε σχετικά παρακάτω).
Στη χημική δομή της, η ελαιοευρωπαΐνη (Ole) περιέχει μια ορθο-διφαινολική ομάδα ικανή να καθαρίσει το ROS μέσω της δωρεάς υδρογόνου και να σταθεροποιήσει της ρίζες οξυγόνου με έναν ενδομοριακό δεσμό υδρογόνου.
Ειδικότερα, μια υποκατάσταση o-diOH προσδίδει υψηλή αντιοξειδωτική ιδιότητα, ενώ οι μεμονωμένες υποκαταστάσεις υδροξυλίου, π.χ., τυροσόλη, δεν παρέχουν καμία [70].
Η Ole in vitro μπορεί να αναστέλλει, με δοσοεξαρτώμενο τρόπο, την οξείδωση της LDL που προκαλείται από θειικά άλατα χαλκού, η οποία αξιολογείται μέσω μείωσης των ουσιών που αντιδρούν με θειοβαρβιτουρικό οξύ και της περιεκτικότητας σε υποπροϊόν του υπεροξειδίου των λιπιδίων [71, 72].
In vivo, τα κουνέλια που τρέφονται με μια πλούσια σε Ole διατροφή έδειξαν υψηλότερα επίπεδα αντιοξειδωτικών ορού ικανά να εξουδετερώσουν την οξείδωση της LDL, και μείωση των συνολικών, ελεύθερων και εστεροποιημένων επιπέδων χοληστερόλης σε σύγκριση με τα ζώα που λαμβάνουν μια τυπική διατροφή [73].
Επιπλέον, της ανθρώπους, η μελέτη των Visioli et al. [74] απέδειξε ότι τα συμπληρώματα Ole σε υγιείς εθελοντές μείωσαν, με δοσοεξαρτώμενο τρόπο, την απέκκριση των ούρων των α8-iso-PGF2, γεγονός που υποδηλώνει χαμηλότερη υπεροξείδωση των λιπιδίων.
Μια επίδραση δράσης της ελεύθερες ρίζες του Ole, παρόμοια με του ασκορβικού οξέος και της α-τοκοφερόλης, παρουσιάστηκε in vitro κατά του υποχλωρικού οξέος, της ισχυρού οξειδωτικού είδους που παράγεται in vivo από ουδετερόφιλη μυελοπεροξειδάση στο σημείο της φλεγμονής [70], καθώς και κατά του μονοξειδίου του αζώτου, αναφέρθηκε από το De la Puerta et al. [75].
Τα πρώτα πειραματικά στοιχεία της άμεσης αντιοξειδωτικής καρδιοπροστατευτικής επίδρασης του Ole κατά της μετά-ισχαιμικής οξειδωτικής έκρηξης μετά από στεφανιαία απόφραξη, αναφέρθηκαν από τους Μanna et al. [76]. Χρησιμοποιώντας απομονωμένες καρδιές αρουραίων που έχουν προεπεξεργαστεί με Ole, υποβάλλονται σε γενική ισχαιμία και στη συνέχεια reperused, παρατήρησαν μια μείωση της κινάσης κρεατίνης και μειωμένη απελευθέρωση γλουταθειόνης στο perfusate, καθώς και μια μείωση της οξειδωμένης γλουταθειόνης και στο επίπεδο υπεροξείδωσης των λιπιδίων.
Η Ole ήταν σε θέση να ασκήσει, έμμεσα, την αντιοξειδωτική της δράση διεγείροντας την έκφραση των ενδοκυτταρικών αντιοξειδωτικών ενζύμων μέσω της επαγωγής της μεταγραφής του Nuclear factor erythroid 2-related factor 2 (NrF2) [77], καθώς και με την αύξηση του επιπέδου των μη ενζυμικών αντιοξειδωτικών της γλουταθειόνη, α-τοκοφερόλης, β-καροτένιου, και ασκορβικού οξέος [78, 79, 5].
Η αντίσταση στην ινσουλίνη είναι μια συστηματική διαταραχή, στην οποία υπάρχει μειωμένη δράση της ινσουλίνης παρά την κατάσταση της «υπερινσουλιναιμίας», που επηρεάζει πολλά όργανα, ιδίως το ήπαρ και τον λιπώδη ιστό, και οδηγεί στην ανάπτυξη δύο ΜΜΑ, τον σακχαρώδη διαβήτη τύπου 2 (T2DM) και του μεταβολικού συνδρόμου, ιδιαίτερα γνωστών παραγόντων καρδιαγγειακού κινδύνου.
Πρόσφατη έρευνα έχει περιγράψει τις ευεργετικές ιδιότητες της Ole και Ole εμπλουτισμένα με εκχυλίσματα φύλλων ελιάς κατά T2DM, και του μεταβολικού συνδρόμου που σχετίζονται με τις συνθήκες.
Ειδικότερα, το Ole εμποδίζει τη συνάθροιση της αμυλίνης σε αμυλοειδή ινιδίων, των οποίων η παγκρεατική παρουσία θεωρείται μία από τις αιτίες της ταλαιπωρίας και της λειτουργικής δυσλειτουργίας των κυττάρων που εκκρίνουν ινσουλίνη στο T2DM (βλέπε παρακάτω) [80]
Οι μελέτες που διεξήχθησαν σε ζωικά και κυτταρικά μοντέλα έχουν αναφέρει ότι το Ole έχει την ιδιότητα της μείωσης των επιπέδων γλυκόζης και χοληστερόλης στο αίμα, και τη βελτίωση της ανοχής στη γλυκόζη και της ευαισθησίας στην ινσουλίνη [81, 82, 83].
Τα ευρήματα αυτά επιβεβαιώθηκαν από τα αποτελέσματα των ανθρώπινων κλινικών δοκιμών που δείχνουν ότι η χορήγηση της Ole βελτίωσε την ομοιόσταση της γλυκόζης, μείωσε τα επίπεδα γλυκοζυλιωμένης αιμοσφαιρίνης και ινσουλίνης νηστείας, γεγονός που υποδηλώνει σημαντική αντιδιαβητική δράση [84, 85, 86].
Είναι ενδιαφέρον, στο πλαίσιο αυτών των τελευταίων μεταβολικών διαταραχών, οι οποίες χαρακτηρίζονται και οι δύο από αντίσταση στην ινσουλίνη, τα αποτελέσματα της μελέτης των de BocK et al. [85] όπου παρουσίασαν αποκατάσταση της ευαισθησίας στην ινσουλίνη και της ικανότητας έκκρισης των παγκρεατικών β κυττάρων, σε μια ομάδα υπέρβαρων μεσήλικων ανδρών που έλαβαν κάψουλες με ελαιοευρωπαΐνης από φύλλα ελιάς για 12 εβδομάδες, επιβεβαιώνοντας προηγούμενα ευρήματα σχετικά με την υπογλυκαιμική επίδραση της ελαιοευρωπαΐνης[80, 87, 88].
3.1 Οι επιδράσεις της ελαιοευρωπαΐνης στην μη αλκοολική λιπώδη ηπατική νόσο (NAFLD)
Μια άλλη ασθένεια που σχετίζεται σε μεγάλο βαθμό με την αντίσταση στην ινσουλίνη και το μεταβολικό σύνδρομο είναι η μη αλκοολική λιπώδης ηπατική νόσος (NAFLD), η οποία επηρεάζει περίπου το 25% του παγκόσμιου πληθυσμού και την ακόλουθη μη αλκοολική στεατοηπατίτιδα (NASH).
Η έρευνα σε μοντέλα κυττάρων και ζώων ανέφερε ότι η Ole μπορεί να εξουδετερώσει αυτές τις καταστάσεις μέσω διαφορετικών δράσεων, συμπεριλαμβανομένων
(i) μιας αντιλιπιδικής δραστηριότητας [89],
ii) της προστασίας και της πρόληψης της ηπατικής βλάβης [90, 91, 92] και
iii) παρεμβαίνοντας στις οδούς σηματοδότησης που εμπλέκονται στη λιπογένεση και στην εμφάνιση λιπώδων ηπατικών παθήσεων [93].
Δυστυχώς, σήμερα τα ευρήματα αυτά λόγο έλλειψης επαρκών στοιχείων από κλινικές μελέτες δεν υποστηρίζονται επαρκώς και παραμένουν αναπόδεικτα.
Εκτός από τις αναφερόμενες ιδιότητες παραπάνω, η ικανότητα της ελαιοευρωπαΐνηςνα αναστέλλει την ενδοθηλιακή ενεργοποίηση, την προσκόλληση των μονοκυττάρων και τη συσσώρευση αιμοπεταλίων εντός του εύρους συγκέντρωσης που αναμένεται μετά τη διατροφική πρόσληψη από την MD, υποδηλώνει ότι η ελαιοευρωπαΐνη μπορεί να θεωρηθεί αντιαθερογόνος παράγοντας, αντανακλώντας την προστατευτική της δραστηριότητα στο CVD [94, 95, 96, 97, 98].
3.2 Η ελαιοευρωπαΐνη ως επαγωγέας αυτοφαγίας
Η αυτοφαγία (autophagy) είναι μια διαδικασία με την οποία τα κύτταρα αφαιρούν τα κατεστραμμένα οργανίδια, τις ακατάλληλες πρωτεΐνες ή τις συσσωρεύσεις αδρανών αμυλοειδών μέσω της λυσοσωμικής υποβάθμισης και αποικοδόμησης.
Αυτή είναι μια διαδικασία που διατηρείται ιδιαίτερα και απαιτείται για τη διατήρηση της κυτταρικής ομοιόστασης. Ξεκινά με το σχηματισμό ενός φαγοφόρου (που συμπίπτει με την απομόνωση της μεμβράνης) που αναπτύσσεται και τερματίζεται με την ολοκήρωση του αυτο-φαγοσώματος, όπου αμέσως μετά ακολουθεί η σύντηξη του με τα λυσοσώματα για να σχηματίσουν αυτο-φαγολυσοσώματα.
Το Beclin-1 και το LC3 είναι τυπικοί δείκτες ενεργοποίησης της αυτοφαγίας, που εμπλέκονται στα πρώτα βήματα του σχηματισμού φαγοφόρου, ενώ το p62 συμμετέχει στην αναγνώριση φορτίου από λυσοσώματα [99].
Ο στόχος του συμπλέγματος ραπαμυκίνης 1 (mTORC1) και η AMP-activated protein kinase (AMPK) είναι οι αισθητήρες του στρες που ελέγχουν την αυτοφαγία. Ωστόσο, ενώ το mTORC1 είναι ένας αναστολέας της αυτοφαγίας ενεργοποιείται από τον ορό, τα θρεπτικά συστατικά, τους αυξητικούς παράγοντες, κ.λπ., η AMPK είναι αντ ‘αυτού ένας επαγωγέας της αυτοφαγίας, ενεργοποιείται από συνθήκες χαμηλής ενέργειας και τις πολυφαινόλες.
Η δυσρυθμισμένη αυτοφαγία είναι ένα κοινό χαρακτηριστικό στις ΜΜΑ που εμπλέκονται στις νευροεκφυλιστικές νόσους (NDD), στο μεταβολικό σύνδρομο, στον διαβήτη, στις CVDs, στις γαστρεντερικές ασθένειες, και τον καρκίνο [4].
Ως κύριος ρυθμιστής του μεταβολισμού των πρωτεϊνών, των λιπιδίων και των υδατανθράκων, η δυσρυθμισμένη αυτοφαγία μπορεί ταυτόχρονα να προωθήσει μεταβολικές διαταραχές και ασθένειες που σχετίζονται με τη γήρανση, τις ανθυγιεινές δίαιτες και τη φλεγμονή.
Πράγματι, νοκ-άουτ του γονιδίου Atg7 σε ποντίκια, ένα απαραίτητο γονίδιο για την αυτοφαγία, δείχνει χαρακτηριστικά σε in vivo την τυπική νόσο του Πάρκινσον (PD) χαρακτηριστικά όπως Lewy bodies (LBs) formation, συμπεριλαμβανομένης της ενδογενούς συνουκλίνης και την νευρική απώλεια, καθώς και ηπατομεγαλία με μεταλλαγμένα ηπατοκύτταρα που δείχνουν συσσώρευση ubiquitin-θετικά αδρανή [100, 101].
Μια υψηλή σε λίπος-διατροφή σε γενετικά παχύσαρκα ποντίκια έδειξε μείωση της ροής της αυτοφαγίας, που συνδέεται με αυξημένη έκφραση γονιδίων των φλεγμονωδών παραγόντων [102, 103, 104].
Ένα ακόμα ενδιαφέρον στοιχείο είναι ότι, η αυτοφαγία φαίνεται να έχει ένα ρόλο στους νευρώνες hypothalamic agouti-related peptide neurons που σχετίζονται με την ρύθμιση της πρόσληψης τροφής και της ενεργειακής ισορροπίας. Αυτό το γεγονός υποδηλώνει πως, η υποθαλαμική αυτοφαγία έχει την ικανότητα να ρυθμίζει την διαμόρφωση της ομοιόστασης της ενέργειας και μπορεί να έχει επιπτώσεις στην ανάπτυξη νέων θεραπευτικών επιλογών για συνθήκες που επικρατούν και έχουν ως αποτέλεσμα την παχυσαρκία, και το μεταβολικό σύνδρομο [105].
Η αυτοφαγορική ροή και διαδικασία αναστέλλεται επίσης στα παγκρεατικά β-κύτταρα που εκτίθενται στα λιπαρά οξέα, καταστέλλοντας κατά συνέπεια την έκκριση ινσουλίνης, ένας κρίσιμος παράγοντας για την ανάπτυξη του T2DM στη μετατροπή του σε διαβήτη τύπου-Ι [106].
Στο πλαίσιο του CDV, αρκετές μελέτες δείχνουν ότι η αυτοφαγία μπορεί να έχει ευεργετικούς ή επιζήμιους ρόλους ανάλογα με το στάδιο και τον τύπο της εξεταζόμενης καρδιαγγειακής νόσου [5].
Μια ευεργετική λειτουργία της αυτοφαγίας έχει παρατηρηθεί στην ισχαιμία-επαναιμάτωση, στην καρδιακή υπερτροφία, και στην κολπική μαρμαρυγή.
Ωστόσο, η πλειοψηφία των καρδιακών διαταραχών υποδηλώνει ότι η αυτοφαγία μπορεί να είναι μια κοινή κυτταρική οδός που μπορεί να στοχεύσει κανείς για θεραπευτικό όφελος, και ο αυξανόμενος αριθμός των καρδιοπροστατευτικών θεραπειών που επηρεάζουν την αυτοφαγική δραστηριότητα επιβεβαιώνεται από πολλά στοιχεία [4, 107, 108].
Η αυτοφαγία είναι επίσης ζωτικής σημασίας για την εντερική ομοιόσταση, τις κατάλληλες εντερικές ανοσολογικές αποκρίσεις, και την αντιμικροβιακή προστασία, καθώς και τις νευρικές και μικρογλοιϊκές λειτουργίες [109].
Εν κατακλείδι, η αυτοφαγία είναι ένας βασικός παράγοντας στην παθογένεση και τη ρύθμιση των διαφόρων ειδών ασθενειών, και χρησιμεύει ως δυναμικός και αποτελεσματικός στόχος για την παρέμβασή τους. Ως εκ τούτου, η χρήση ουσιών, όπως οι πολυφαινόλες, που ρυθμίζουν την αυτοφαγία και ελαχιστοποιούν την παράπλευρη επίδραση, μπορεί να είναι μια έγκυρη θεραπευτική προσέγγιση [110, 111].
Μελέτες έχουν δείξει την ευεργετική ενέργεια της ελαιοευρωπαΐνηςκατά παθολογιών που αφορούν δυσλειτουργία της αυτοφαγίας, και που ενεργεί ως ενισχυτικό αυτής μέσω διάφορων μηχανισμών, καθώς και την πιθανή χρήση της ως nutraceutical.
3.3 Η ελαιοευρωπαΐνη και οι νευροεκφυλιστικές νόσοι (NDDs)
Σε μελέτη που πραγματοποιήθηκε σε κυτταρικές σειρές νευροβλαστώματος, διαπιστώθηκε ότι η ελαιοευρωπαΐνη (Ole) προκάλεσε αυτοφαγία με την ενεργοποίηση του άξονα σηματοδότησης Ca2 +/Calmodulin πρωτεΐνη κινάση κινάση β (CaMKkβ)/AMPK/ mTOR.
Προτάθηκε ότι, η Ole θα μπορούσε να προκαλέσει την αυτοφαγία μέσω μιας αύξησης του Ca2+ στο κυτταρόπλασμα από στο ενδοπλασματικό δίκτυο που, με τη σειρά του, ενεργοποίησε το Ca2+/CaMKKβκ, και στη συνέχεια σηματοδότηση-καταρράκτη AMPK. Αυτό το σύμπλεγμα διευκολύνει την αναστολή mTORC1 και την ενεργοποίηση ULK1 για να παραγάγει την αυτοφαγική επαγωγή στα λυσοσώματα. Έχει αποδειχθεί ότι, τα κύτταρα SH-SY5Y που υποβλήθηκαν σε θεραπεία με 50 μM Ole παρουσίασαν αυξημένο επίπεδο Beclin-1, παράγοντας ιδιαίτερα κρίσιμος για την πρόκληση της αυτοφαγίας, που σχετίζεται με την φωσφορυλίωση της ελαιοευρωπαΐνης της Thr172 του AMPK [112].
Οι επιδράσεις της Ole ως προαγωγέα της αυτοφαγίας έχουν επίσης διερευνηθεί σε ζωικά διαγονιδιακά μοντέλα [113]. Τα δεδομένα από τις μελέτες αυτές δείχνουν ότι η αυτοφαγία μπορεί να θεωρηθεί ως στρατηγικός αντι-αμυλοειδείς μηχανισμός, και δείχνουν ότι η Ole ή/και τα παράγωγά της μπορεί να ασκήσει νευροπροστατευτική λειτουργία της στον εγκέφαλο, διασχίζοντας τον εγκεφαλονωτιαίο φραγμό, ενισχύοντας την κάθαρση της εναπόθεσης πλάκας Aβ.
Η γνωστική ανάκαμψη σε αυτά τα ζωικά μοντέλα της νόσου του Alzheimer (AlzD) υποστηρίζει την υπόθεση, ότι μια διατροφή που συμπληρώνεται με αυτές τις πολυφαινόλες μπορεί να έχει ευεργετικά αποτελέσματα στην επιβράδυνση της γνωστικής παρακμής σε ασθενείς με κλινικά συμπτώματα αυτής της νόσου.
3.4 Η ελαιοευρωπαΐνη και η καρδιοπροστασία
Η έρευνα των Miceli et al. [113] μελέτησε την επίδραση της Ole ως ενισχυτή της αυτοφαγίας σε ένα μοντέλο καρδιομυοκυττάρων, που χαρακτηρίζεται από δυσλειτουργία της αυτοφαγίας που προκαλείται από οξειδωτικό στρες λόγω μιας υπερέκφρασης μονοαμινοξειδάσης-Α (ΜΑΟ-Α).
Το MAO-A είναι μια ισομορφή των ενζύμων που εξαρτώνται από τα FAD εξαρτώμενα ένζυμα, και καταλύει την οξειδωτική deamination των κατεχολαμινών και της σεροτονίνης στην καρδιά, παράγοντας την αντίστοιχη αλδεΰδη, H2O2, και αμμωνία.
Προηγούμενες μελέτες έχουν αναφέρει ότι η έκφραση και η δραστηριότητα του ΜΑΟ-Α αυξήθηκαν σε χρόνιες καρδιακές παθήσεις [114, 115, 116, 117]. Διαπίστωσαν ότι η Ole προσφέρει καρδιοπροστασία, όχι μόνο από την αντιοξειδωτική δράση της, αλλά και μέσω της αποκατάστασης των ελαττωμάτων στην ροή της αυτοφαγίας.
Αυτό αντικατοπτρίζεται από τον σχηματισμό των αυτο-φαγολυσοσωμάτων, που μετράται από την αύξηση των επιπέδων των πρωτεϊνών p62 και cathepsin-B, και την ενεργοποίηση και μετατόπιση στον πυρήνα του παράγοντα μεταγραφής EB (transcriptional factor EB, TFEB).
Η μετατόπιση του TFEB στον πυρήνα διαμόρφωσε τη μεταγραφή των γονιδίων της αυτοφαγίας που αποτρέπεται από την ενεργοποίηση ΜΑΟ-Α, μειώνοντας τη μεταγραφική του δραστηριότητα.
Έχει αποδειχθεί, ότι η μεταγραφική ρύθμιση της αυτοφαγίας από την Ole συσχετίστηκε με μια σημαντική μείωση του θανάτου των κυττάρων, και της αποκατάστασης της λειτουργικότητας των μιτοχονδρίων.
Αυτές οι βελτιώσεις εξαφανίστηκαν μετά την αναστολή του TFEB, οδηγώντας στην υπόθεση ότι η δραστηριότητα του TFEB ήταν ζωτικής σημασίας για τις προστατευτικές επιδράσεις της Ole κατά της δυσλειτουργίας αυτοφαγίας που προκαλείται από την MAO-A.
Επιπλέον, η μετατόπιση TFEB και η αποκατάσταση της αυτοφαγίας που προκλήθηκαν από την Ole δεν επηρέασαν την κατάσταση ROS στα καρδιομυοκύτταρα, τονίζοντας περαιτέρω την ιδιαιτερότητά της ως επαγωγέα αυτοφαγίας.
3.5 Η ελαιοευρωπαΐνη ως αντι-αμυλοειδές εργαλείο
Πολλές νευροεκφυλιστικές παθολογίες, μεταξύ των οποίων οι πιο συχνές είναι AlzD και PD, μαζί με τον T2DM, είναι αμυλοειδείς ασθένειες (AD), και ανήκουν στην ομάδα ΜΜΑ. Σε γενικές γραμμές, οι AD είναι ασθένειες που είναι δυνητικά θανατηφόρες, που ορίζονται από την εμφάνιση εναπόθεσης αδιάλυτου πολυμερούς υλικού, που προέρχονται από αναδιπλωμένες πρωτεΐνες (αμυλοειδούς) σε διάφορα όργανα.
Ο πυρήνας αυτών των αμυλοειδών αποτελείται από μη διασπόμενα πολυμερή ινίδια χαρακτηρισμένων πρωτεϊνών ή πεπτιδίων, που είναι τυπικά για κάθε ασθένεια, όπως τα πεπτίδια A για AlzD, α-συνουκλίνη για PD, amylin (hIAPP) για T2DM, και μορφυρετίνη (TTR) για την οικογενή αμυλοειδή καρδιομυοπάθεια [118 119 120].
Οι αμυλογενείς πρωτεΐνες χαρακτηρίζονται από την διαμόρφωση β φύλλου, και μοιράζονται μια κοινή οδό σχηματισμού των ινιδίων. Αυτή η τελευταία είναι μια σύνθετη διαδικασία που περιλαμβάνει το σχηματισμό μιας ενδιάμεσης (διαλυτής) μορφής ολιγομερούς, που ακολουθείται από την ανάπτυξη των αδιάλυτων πρωτοινιδίων. Πρόσφατα ορισμένοι συγγραφείς έχουν αποδείξει ότι η κυτταροτοξικότητα των διαφόρων αμυλογενών πρωτεϊνών οφείλεται σε διαλυτά, ενδιάμεσα ολιγομερικά είδη, και όχι στα αδιάλυτα ινιδιακά αμυλοειδή [121].
Η κυτταροτοξικότητα τους περιλαμβάνει τη διαταραχή της ομοιόστασης του ασβεστίου, την αποσταθεροποίηση των μεμβρανών, την παραγωγή ROS και την επαγωγή απόπτωσης. Όλοι αυτοί οι παράγοντες που καθορίζουν την ταλαιπωρία των κυττάρων και το θάνατο τους [122].
Είναι ενδιαφέρον ότι, οι νευροεκφυλιστικές ασθένειες μπορεί να επεκταθούν και έξω από το κεντρικό νευρικό σύστημα (ΚΝΣ), και μπορεί επίσης να περιλαμβάνουν το γαστρεντερικό σωλήνα (GI).
Πράγματι, τα ίδια πρωτεϊνικά αδρανή υλικά υπάρχουν τόσο στο εντερικό νευρικό σύστημα (ENS) όσο και στο ΚΝΣ, οδηγώντας στην υπόθεση ότι η ασθένεια μπορεί να ξεκινήσει στο ENS και στη συνέχεια να εξαπλωθεί ανάδρομη προς το ΚΝΣ, ή το αντίστροφο, και υποδηλώνει ότι μπορεί να εξαπλωθεί μέσω μιας μορφής πριόν-όπως της συσσώρευσης misfolded πρωτεΐνης, λόγω μιας ανισορροπίας μεταξύ της παραγωγής τους και της κάθαρσης από τα συστήματα της αυτοφαγίας [123] .
Έτσι, η έρευνα των ενώσεων που παρεμβαίνουν με τη συνάθροιση των αμυλοειδών πρωτεϊνών αναγνωρίζεται ως μια πολύτιμη προσέγγιση για την έρευνα και ανάπτυξη νέων θεραπευτικών μορίων.
Αυτό ισχύει ιδιαίτερα για την AlzD, η πιο κοινή μορφή της άνοιας που σχετίζονται με νευροεκφυλιστική νόσο μεταξύ των ηλικιωμένων (ηλικίας 60 ετών και άνω), που χαρακτηρίζεται από μια προοδευτική μείωση της γνωστικής λειτουργίας και της μνήμης.
Οι συσσωρεύσεις των πεπτιδίων Aβ και τα συμπλέγματα των νευροινιδίων των υπερφωσφορυλιωμένων πρωτεϊνών tau που εμφανίζονται στους νευρώνες του υποθαλάμου και του φλοιού είναι τυπικά χαρακτηριστικά αυτής της ασθένειας.
Στην PD που είναι η δεύτερη πιο κοινή νευροεκφυλιστική ασθένεια, χαρακτηρίζεται από εκφυλισμό των ντοπαμινεργικών νευρώνων στην substantia nigra pars compacta λόγω της εναπόθεσης των ενδοκυτταρικών εγκλεισμάτων γνωστή ως LBs, το κύριο συστατικό των οποίων είναι α-synuclein.
Αν και οι κλινικές παθολογίες αυτών των ασθενειών έχουν περιγραφεί εδώ και πολύ καιρό, σήμερα υπάρχουν διαθέσιμα φάρμακα μόνο αποτελεσματικά στη μείωση των συμπτωμάτων αυτών των ασθενειών.
Η εναπόθεση γεροντικών πλακών και LBs σε νευρικά κύτταρα προκαλεί χρόνιο στρες, συμπεριλαμβανομένου του οξειδωτικού στρες και της ενεργοποίησης των μικρογλοιικών κυττάρων για την απελευθέρωση αρκετών προ-φλεγμονωδών κυτοκινών, χημειοκινών και ROS, που είναι η κύρια αιτία αυτών των διαταραχών [124].
Η Ole έχει βρεθεί να μειώνει τον σχηματισμό των τοξικών ολιγομερών σε in vitro πειράματα του πεπτιδίου Aβ και την συνάθροιση του αμυλοειδούς της α-συνουκλεΐνης, καθώς και να επάγει την απώλεια συσσώρευσης των ινιδίων και των πλακών [125, 126, 127].
Οι δράσεις αυτές αντικατοπτρίζουν τις ευεργετικές επιδράσεις της κατά της τοξικότητας του αμυλοειδούς σε καλλιεργημένα κύτταρα [125] και σε διαγονιδιακά μοντέλα ζώων [128, 129].
Η hIAPP είναι μια πεπτιδική ορμόνη που συν-εκκρίνεται με την ινσουλίνη από τα παγκρεατικά β-κύτταρα. Εναποθέσεις αδρανών ινιδίων του hIAPP αμυλοειδούς στις νησίδες του Langerhans είναι ένα πολύ γνωστό χαρακτηριστικό του T2DM.
Η συγκέντρωση hIAPP μαζί με το οξειδωτικό στρες (μέσω NADPH-οξειδάσης) οδηγεί στην hIAPP- τοξικότητα, και διαδραματίζει έναν κεντρικό ρόλο στην παθογένεση του T2DM [130, 131].
Η μελέτη των Rigacci et al. [80] έδειξε ότι, η ύπαρξη της ελαιοευρωπαΐνης(Ole), κατά τη διάρκεια της διαδικασίας συσσώρευσης, οδήγησε το σχηματισμό δομικά διαφορετικών αδρανών υλικών εμποδίζοντας τη σύνδεση τους με τα κύτταρα της μεμβράνης, με αποτέλεσμα τη μείωση της βλάβης της μεμβράνης, και την προστασία των κυττάρων ινσουλινώματος των αρουραίων από την συνολική κυτταροτοξικότητα, η κύρια πτυχή που ευθύνεται για την κυτταρική παθολογία.
Παρόμοια αποτελέσματα προέκυψαν από τον Leri et al. [132] που επεκτείνουν το παραπάνω εύρημα στο σύστημα Ole/TTR, το τελευταίο εμπλέκεται σε ένα υποσύνολο των οικογενών ή σποραδικών αμυλοειδών ασθενειών συμπεριλαμβανομένης της γεροντικής συστηματικής αμυλοείδωσης (SSA), της οικογενειακής αμυλοαυλογενεσίας και της καρδιομυοπάθειας (FAP/FAC), για την οποία δεν έχει ακόμη βρεθεί αποτελεσματική θεραπεία.
Αυτή η πολυφαινόλη ήταν σε θέση να επηρεάσει τη συναρμολόγηση του ινιδίου TTR και να προωθήσει την ώριμη διαταραχή του ινιδίου. Σε αυτή τη μελέτη, η προστασία της Ole από την τοξικότητα του αμυλοειδούς TTR, η οποία δοκιμάστηκε σε in vitro κύτταρα HL-1, προέκυψε από τη σταθεροποίηση ενός ενδιάμεσου μέσου που μοιάζει με ολιγομερές και αλληλοεπιδρά με τη κυτταροπλασματική μεμβράνη χωρίς να αλλοιώνει την ακεραιότητά της. Επιπλέον, διαπιστώθηκε επίσης ότι η Ole ήταν σε θέση να αποσυναρμολογήσει τα προσχηματισμένα ώριμα ινίδια TTR στα ίδια μη τοξικά ενδιάμεσα προϊόντα [132].
Μια άλλη ενδιαφέρουσα πτυχή της αντικυτταροτοξικής δράσης της Ole αναφέρθηκε από Leri et al. [133] και αφορά την β2-μικροσφαιρίνης (β2m) που ανήκει στο κύριο σύμπλεγμα ιστοσυμβατότητας κατηγορίας Ι (MHC I) που σχετίζεται με μια οικογενειακή μορφή συστηματικής αμυλοείδωσης.
Σε αυτή τη μελέτη, διαπιστώθηκε ότι η Ole τροποποίησε όχι μόνο τις διαμορφωτικές και βιοφυσικές ιδιότητες των ινιδίων των αμυλοειδών, ευνοώντας την εμφάνιση μη τοξικών αδρανών, αλλά και τροποποίησε τις ιδιότητες της επιφάνειας των κυτταρικών μεμβρανών, μειώνοντας τη συνολική αλληλεπίδραση με τη κυτταροπλασματική μεμβράνη των εκτεθειμένων κυττάρων. Έτσι ενισχύεται η κυτταρική αντίσταση έναντι των τοξικών επιδράσεων αυτών των αδρανών υλικών [134, 135, 136, 137].
Όλα αυτά τα δεδομένα υποδεικνύουν μια πιθανή χρήση της Ole ως ένα νέο και πολλά υποσχόμενο εργαλείο, ενεργώντας άμεσα στο σχηματισμό αμυλοειδούς μέσω της οδού αυτοσυναρμολόγησης πρωτεϊνών, για την πρόληψη και τη συνδυαστική θεραπεία της συστηματικής αμυλοείδωσης».
3.6 Οι επιδράσεις της ελαιοευρωπαΐνηςστην παχυσαρκία
Στην μελέτη ανασκόπησης της διεθνούς βιβλιογραφίας από της Javed Ahamad και συνεργάτες [29] με τίτλο: «Ελαιοευρωπαΐνη: Ένα φυσικό αντιοξειδωτικό μόριο για την αγωγή του μεταβολικού συνδρόμου», αναλύοντας της μελέτες των Knowler, W. C., και συνεργατών … Mahmoudi, A.,και συνεργατών [138-212], οι συντάκτες της μελέτης της περιγράφουν: «Η παχυσαρκία είναι ένας σημαντικός παράγοντας για την ανάπτυξη του διαβήτη, και η απώλεια βάρους έχει συσχετιστεί με καλύτερο γλυκαιμικό έλεγχο [138, 139].
Η αύξηση του ενδοκοιλιακού λίπους προδιαθέτει τα άτομα σε επιπλοκές της αντίστασης στην ινσουλίνη και της παχυσαρκίας [140, 141, 142], και το αυξημένο σπλαχνικό λίπος έχει συσχετιστεί με την αύξηση των τριγλυκεριδίων (TGs) πλάσματος, μειωμένη HDL χοληστερόλη και αυξημένα επίπεδα γλυκόζης, και τον κίνδυνο για τον T2D [143, 144, 145].
Η μείωση της παχυσαρκίας, η επιβράδυνση της αύξησης βάρους, ή η διακοπή της περαιτέρω αύξησης βάρους θα ήταν ευεργετική για τον έλεγχο του T2D [138-139].
Η ελαιοευρωπαΐνη (Ole) έχει αναφερθεί ότι μειώνει σε ζωικά μοντέλα το σωματικού βάρος και το επίπεδο του κοιλιακού λιπώδους ιστού [146] μέσω της καταστολής της μιτοχονδριακής δραστηριότητας κατά τη διάρκεια της αδιπογενούς διαφοροποίησης και έκφρασης των γονιδίων που εμπλέκονται στην αδιπογένεση.
Οι Santiago-Moraet al. (2011) [147] διαπίστωσαν ότι, η Ole ανέστειλε τον υποδοχέα peroxisome proliferator-activated receptor gamma 2 (PPARγ2), την λιποπρωτεΐνη λιπάση (LPL), και το γονίδιο fatty acid-binding protein 4 (FABP-4).
Ο PPAR-γ έχει συνδεθεί με τη διαφοροποίηση των μακροφάγων των λιποκυττάρων στην αντιφλεγμονώδη μορφή Μ2 [148], η οποία έχει συνδεθεί με τη μεταβολική υγεία και την καλύτερη ευαισθησία στην ινσουλίνη [149, 150].
Η μελέτη από τους Dira, Chen, και Sakamoto (2011) [151], διαπίστωσε ότι η μείωση της συσσώρευσης ενδοκυτταρικού λίπους με την χρήση της ελαιοευρωπαΐνηςκατά 40% και 70% στα επίπεδα δόσης των 200 και 300 μΜ, αντίστοιχα. Μείωσε επίσης τη διαφοροποίηση των λιποκυττάρων και μείωσε τη δραστηριότητα του GPDH με δοσοεξαρτώμενο τρόπο.
Το οξειδωτικό στρες έχει επίσης συνδεθεί με την αυξημένη διαφοροποίηση των λιποκυττάρων μέσω της επιτάχυνσης της εξέλιξης του κυτταρικού κύκλου [152] και η SREBP-1c ενεργοποίηση και επακόλουθη συσσώρευση λιπιδίων έχει αποδοθεί στο οξειδωτικό στρες [153].
Η Ole θα μπορούσε να εξουδετερώσει και τις δύο αυτές δράσεις, δεδομένου ότι είναι ένα ισχυρό αντιοξειδωτικό. Σε μια άλλη μελέτη, η παρουσία PPARγ, SREBP-1c, και FAS ως αποτέλεσμα μιας διατροφής υψηλής χοληστερόλης ήταν σημαντικά χαμηλότερη σε ποντίκια που τρέφονται με ελαιοευρωπαΐνη. Η μελέτη αυτή διαπίστωσε επίσης ότι η ελαιοευρωπαΐνη αύξησε την φωσφορυλίωση της AMPK στον λιπώδη ιστό [154].
3.7 Οι αντιδιαβητικές επιδράσεις της ελαιοευρωπαΐνηςς
Η έγχυση φύλλων ελιάς ή/και τα αφέψημα έχουν χρησιμοποιηθεί παραδοσιακά στον διαβήτη σε διάφορες μελέτες κυταροκαλλιεργειών και μοντέλα ζώων [154-159].
Η ελαιοευρωπαΐνη εμπλέκεται στη βελτίωση του μεταγευματικού γλυκαιμικού προφίλ μέσω της παρεμπόδισης του οξειδωτικού στρες που προέρχεται από το NOX2 [160, 161].
Λαμβάνοντας υπόψη ότι η παθογένεση του T2D συνεπάγεται την περιφερική δυσλειτουργία πρόσληψης της γλυκόζης, η ελαιοευρωπαΐνη θα μπορούσε να διαδραματίσει ρόλο συνδυαστικά τόσο στη θεραπεία όσο και στην πρόληψη μιας και μελέτες έχουν δείξει ότι αυξάνει την ευαισθησία στην ινσουλίνη F. Hadrich, Mahmoudi, et al. (2016) [162].
Στην μελέτη των de Bock et al., η ταυτόχρονη ημερήσια πρόσληψη 51mg ελαιοευρωπαΐνης και 9,5mg υδροξυτυροσόλης για 12 εβδομάδες βελτίωσε σημαντικά την ευαισθησία στην ινσουλίνη και την εκκριτική παγκρεατική ικανότητα των β κυττάρων σε υπέρβαρους μεσήλικες άνδρες που διατρέχουν κίνδυνο ανάπτυξης του μεταβολικού συνδρόμου [163].
3.8 Οι επιδράσεις της ελαιοευρωπαΐνηςστη δυσλιπιδαιμία
Τα υψηλά επίπεδα LDL, ολικής χοληστερόλης (TC) και χαμηλής HDL σχετίζονται με αυξημένο καρδιαγγειακό κίνδυνο και ανάπτυξη αθηροσκληρωτικών πλακών, CVD και θνησιμότητας από όλες τις αιτίες [164, 165, 166].
Η βελτίωση του λιπιδικού προφίλ μπορεί να έχει προστατευτική και προληπτική επίδραση στους κινδύνους που σχετίζονται και με τον T2D. Το γεγονός αυτό υποστηρίζεται από τις άμεσες ενδείξεις άμεσου αυξημένου κινδύνου T2D που σχετίζεται με διαταραγμένο προφίλ λιπιδίων [167, 168, 169, 170], και την επιβλαβή επίδραση των υψηλών συγκεντρώσεων των λιπιδίων που έχουν στη λειτουργία των β κυττάρων [171, 172].
Επιπλέον, η αντιυπερλιπιδαιμική θεραπεία σε διαβητικούς αποδεικνύεται αποτελεσματική για τη μείωση των πρωτοπαθών καρδιαγγειακών επεισοδίων [173, 174], και τα αυξημένα επίπεδα της HDL έχουν συσχετιστεί με μειωμένο κίνδυνο ανεπιθύμητων ενεργειών [175].
Η ελαιοευρωπαΐνη έχει αποδειχθεί ότι μειώνει τον ορό την LDL [176, 177, 178, 179, 180], τα TC [176, 177 178, 179, 181, 182] και τα τριγλυκερίδια ορού[176, 177, 179, 181, 182], ενώ παράλληλα αυξάνει την HDL ορού [176, 177, 178, 179, 180, 183].
Η μελέτη των Malliou et al., το 2018, διαπίστωσε ότι η ελαιοευρωπαΐνη ενίσχυσε την έκφραση του υποδοχέα LDL-R στο ήπαρ και αύξησε την έκφραση άλλων γονιδίων που εμπλέκονται στη σύνθεση, την πρόσληψη, τη μεταφορά, το μεταβολισμό, και την εξάλειψη των TGs [184].
Τα στοιχεία αυτά δείχνουν ότι η Ole μπορεί να έχει έναν παρόμοιο μηχανισμό δράσης για όσον αφορά τα φάρμακα που μειώνουν τα λιπίδια, αν και δυνητικά με σχετικά πολύ μικρό κίνδυνο σχετιζόμενων πιθανών ανεπιθύμητων ενεργειών.
Θα μπορούσε να υποτεθεί ότι η ελαιοευρωπαΐνη θα έχει ευεργετική ή προστατευτική επίδραση βελτιώνοντας το προφίλ των λιπιδίων, διατηρώντας την β λειτουργία των κυττάρων και μειώνοντας τον κίνδυνο ανεπιθύμητων ενεργειών, της εξέλιξης της T2D, των επιπλοκών της και της θνησιμότητας που σχετίζονται με αυτόν.
3.9 Οι αντι-αθερογόνες επιδράσεις της ελαιοευρωπαΐνηςς
Η ελαιοευρωπαΐνη έχει αποδειχθεί ότι είναι ένας ισχυρός αντιφλεγμονώδης και το έχει αποδείξει σε αρκετές μελέτες. Η φλεγμονώδης υπόθεση της αθηροσκλήρωσης έχει αποκτήσει πολλά αποδεικτικά στοιχεία υποστήριξης. Ένα μέρος αυτής της διαδικασίας περιλαμβάνει την απελευθέρωση των προφλεγμοδών μορίων σηματοδότησης σε απάντηση της ανοσολογικής ενεργοποίησης.
Στις νέες πλάκες, υπάρχει μια αρχική ενεργοποίηση των ενδοθηλιακών κυττάρων, τα οποία απελευθερώνουν χημειοτακτικά μόρια [185] και εκφράζουν μόρια πρόσφυσης [186] προσελκύοντας λευκοκύτταρα.
Αυτό συμβαίνει ως απάντηση σε μια φλεγμονώδη αντίδραση μέσα στα κύτταρα. Τα λευκοκύτταρα αποδίδουν και στη συνέχεια μεταναστεύουν ενδοκυτταρικά και διακυτταρικά στο ενδοθήλιο μέσω αυτών των μορίων προσκόλλησης 187].
Η ελαιοευρωπαΐνη μπορεί να αναστέλλει ή να παρεμβαίνει στην απελευθέρωση κυτοκινών και να διακόπτει τον καταρράκτη της εισβολής των λευκοκυττάρων και της συσσώρευσης της πλάκας.
Το οξειδωτικό στρες μπορεί επίσης να διαδραματίσει ρόλο στην ενεργοποίηση των ενδοθηλιακών κυττάρων στην αθηροσκλήρωση [188], και τα αντιοξειδωτικά έχουν αποδειχθεί ότι εμποδίζουν τουλάχιστον την ενεργοποίηση από το TNF-α.
Επιπλέον, υπάρχουν επίσης ενδείξεις ότι το οξειδωτικό στρες και οι ROS εμπλέκονται στην ενεργοποίηση κυτοκινών και του μορίου αγγειακής προσκόλλησης κυττάρων-1 (VCAM-1) [189, 190].
Ο ρόλος των αντιοξειδωτικών στην έκφραση και τη δραστηριότητα του VCAM-1 τονίζεται στην ανασκόπηση από Cook-Mills et al. (2011) [187], και η ελαιοευρωπαΐνη που είναι το ισχυρό αντιοξειδωτικό, θα μπορούσε να συμβάλει στην αναστολή ή επιβράδυνση του σχηματισμού αθηροσκληρωτικών πλακών μέσω της αντιοξειδωτικής μείωσης της εισβολής λευκοκυττάρων.
Η ελαιοευρωπαΐνη έχει αποδειχθεί ότι ενεργοποιεί το AMPK [176], και λαμβάνοντας υπόψη την ενεργοποίηση της AMPK έχει συνδεθεί στενά με τη μείωση των φλεγμονωδών κυτοκινών [191].
Ο TNF-α έχει επίσης αποδειχθεί ότι προκαλεί ή να ενισχύει τον ICAM-1 [192, 193], τον οποίο η ελαιοευρωπαΐνη μπορεί να μειώσει. Αυτό μπορεί να διαδραματίσει ρόλο στην πρόληψη ή την εξασθένιση της φλεγμονώδους διαδικασίας που εμπλέκεται στην αθηροσκληρωτική γένεση της πλάκας.
Μια βιβλιογραφική ανασκόπηση από Gao et al. (2017) [194], έδειξε αντιπροσωπευτικά σαφώς τη συσχέτιση μεταξύ της κυκλοφορούσας οξειδωμένης LDL (oxLDL) και την ανάπτυξη της αθηροσκληρωτικής CVD.
Η OxLDL συνδέεται επίσης με την ανάπτυξη του διαβήτη. Τα πλούσια σε λιπαρά μακροφάγα μπορούν στη συνέχεια να αποθέσουν τις αθηροσκληρωτικές πλάκες και να συμβάλουν στην περαιτέρω ανάπτυξη. Η ελαιοευρωπαΐνη αναστέλλει επίσης τη σύνθεση oxLDL [195]. Το οξειδωτικό στρες έχει συνδεθεί με την οξείδωση της LDL.
Η OxLDL συνδέεται επίσης με την upregulation ενός υποδοχέα που ονομάζεται LOX-1. Το LOX-1 είναι ένας υποδοχέας LDL που βρίσκεται κυρίως σε ενδοθηλιακά κύτταρα αλλά και σε μακροφάγα και λείους μυς και έχει συσχετιστεί με την ανάπτυξη ενδοθηλιακής δυσλειτουργίας, αθηροσκλήρωσης και ισχαιμίας του μυοκαρδίου [196].
Η ενεργοποίηση του LOX-1 μειώνει τη σύνθεση του NO και αυξάνει την έκφραση του ACE μετά την ενεργοποίησή του από το oxLDL. Μπορεί επίσης να ενεργοποιήσει τον τύπο 1 υποδοχέων αγγειοτενσίνης 2, να προκαλέσει το σχηματισμό ROS με την ενεργοποίηση του NF-κB, να αυξήσει την έκφραση VCAM-1 και ICAM-1, και να μειώσει την ενδοθηλιακή έκφραση συνθάσης του μονοξειδίου του αζώτου και τις δραστηριότητες SOD, ενώ η φωσφορυλίωση του NF-κB και p38 MAPK αυξάνεται [196].
Η ελαιοευρωπαΐνη ενεργοποιεί το PPAR-α και το PPAR-α/γ και η ενεργοποίηση αυτή έχει συσχετιστεί με την μείωση της ομοκυστεΐνης, ενός γνωστού ανεξάρτητου παράγοντα κινδύνου καρδιαγγειακής νόσου και αθηροσκλήρωσης [197], η οποία υποβαθμίζει την έκφραση της ανδιάγοντης συνθάσης νιτρικού οξειδίου σε κύτταρα αφρού (foam cells) που προέρχονται από μονοκύτταρα [198].
3.10 Οι αντιυπερτασικές επιδράσεις της ελαιοευρωπαΐνηςς
Σε ένα μοντέλο ταυτόχρονης υπέρτασης και διαβήτη, η ημερήσια δόση της ελαιοευρωπαΐνηςέως και 115mM ημερησίως προκάλεσε σημαντική μείωση της συστολικής αρτηριακής πίεσης [199], μειωμένη νεφρική υπέρταση [199, 200], βελτίωσε το οξειδωτικό στρες [201], και μετρίασε τις αρνητικές επιπτώσεις της αγγειοτενσίνης 2 στα επιθηλιακά προγονικά κύτταρα [202].
Μια καθημερινή συμπλήρωση των 56mM βρέθηκε επίσης να μειώνει τόσο συστολική όσο και την διαστολική αρτηριακή πίεση στις γυναίκες [203].
Tα Il-6 επίπεδα έχουν συσχετιστεί με υψηλή αρτηριακή πίεση [204], και η ελαιοευρωπαΐνη μειώνει την IL-6 σύνθεση σε μακροφάγα και αδιποκύτταρα μέσω AMPK [190], και έχει επίσης αποδειχθεί ότι μειώνει την IL-6 στον εγκεφαλικό ιστό [205].
3.11 Οι αντιφλεγμονώδεις επιδράσεις της ελαιοευρωπαΐνης
Η χρόνια φλεγμονή ή μικροφλεγμονή σχετίζεται με τον λιπώδη ιστό, την παχυσαρκία και την ενεργοποίηση των ανοσολογικών αποκρίσεων και έχουν συνδεθεί άμεσα με την ανάπτυξη και την εξέλιξη του διαβήτη [206, 207]. Η ελαιοευρωπαΐνη έχει αναφερθεί ότι αναστέλλει την λευκοτριίνη Β4 μέσω αναστολής της 5-λιποοξυγενάσης [202, 208, 209].
Αποδείχθηκε επίσης ότι, μειώνει την παραγωγή COX-2 και προσταγλανδίνης Ε2 [210]. Αποδείχθηκε επίσης ότι μειώνει τη φλεγμονή εμποδίζοντας την IL-4 ενεργώντας σε επίπεδο της μεταγραφής και εμποδίζοντας επίσης τη διείσδυση ηωσινοφίλων και μακροφάγων [211].
Μέσω καταστολής της οδού σηματοδότησης p38, μειώνεται η έκφραση του TNF-α και του NF-κB [212], και ταυτόχρονα μείωσε την έκφραση του NF-kB [210, 212] με μία μελέτη όπου δείχνει αναστολή της μετατόπισης της υπομονάδας p65 [210].
Επιπλέον, η ελαιοευρωπαΐνη έχει αποδειχθεί ότι ενεργοποιεί την AMPK και η ενεργοποίηση του AMPK έχει συνδεθεί με μείωση της έκκρισης IL-1β, IL-6 και TNF-α καθώς και αναστέλλει την ενεργοποίηση του NFkB σε πολλούς τύπους κυττάρων. Η ενεργοποίηση του AMPK έχει αποδειχθεί ότι αναστέλλει τη σύνθεση TNF-α, IL-1β και IL-6 σε μακροφάγα και την σύνθεση IL-6 και IL-8 σε λιποκύτταρα [190].
Επιπλέον, μια μελέτη διαπίστωσε ότι τα καθημερινά συμπληρώματα πολυφαινολών ελιάς μείωσαν σημαντικά τα επίπεδα c-αντιδρώσας πρωτεϊνης που υποδεικνύουν μια ισχυρή αντιφλεγμονώδη δράση [203]. Λαμβάνοντας υπόψη το ευρύ φάσμα των αντιφλεγμονωδών μηχανισμών της ελαιοευρωπαΐνης, είναι εύλογο να υποτεθεί ότι η μακροχρόνια χρήση της ελαιοευρωπαΐνης θα παρείχε κάποιο βαθμό προστασίας από αυτόν τον τρόπο αντίστασης στην ινσουλίνη.
Μια κατάσταση χρόνιας υποκλινικής φλεγμονής έχει επίσης υποτεθεί ότι έχει σημασία στην παχυσαρκία [207], και η Ole μπορεί να μειώσει αυτή τη φλεγμονή και επίσης να προστατεύσει από τυχόν κινδύνους που προκαλούνται από αυτό.
Μια δόση 52-mg ελαιοευρωπαΐνης και υδροξυτυροσόλης 10 mg βρέθηκε επίσης να βελτιώνει την αγγειακή λειτουργία και να μειώνει την παρουσία φλεγμονωδών δεικτών σε υγιή άτομα [208]».
4. Επιπτώσεις στην υγεία των φαινολικών ενώσεων που βρίσκονται στο εξαιρετικό παρθένο ελαιόλαδο (EVOO)
Στην ανασκόπηση της διεθνούς βιβλιογραφίας από τους Annalisa Romani, και συνεργάτες με τίτλο [59]: «Επιπτώσεις στην υγεία των φαινολικών ενώσεων που βρέθηκαν στο εξαιρετικό παρθένο ελαιόλαδο, υποπροϊόντα και φύλλα Ole europaea L.», αναλύοντας της μελέτες των Keys A., και συνεργατών … Cordero J.G., και συνεργατών [218-282], οι συντάκτες της μελέτης της περιγράφουν: «Οι καρδιοπροστατευτικές ιδιότητες της μεσογειακής διατροφής (MD), που σχετίζονται κυρίως με τις ευεργετικές επιδράσεις του EVOO, καταδείχτηκαν για πρώτη φορά στη μελέτητων καρδιαγγειακών παθήσεων (SCSCD) επτά χωρών [218].
Η MD αποτελείται από μια ισορροπημένη κατανάλωση φρούτων, λαχανικών, οσπρίων και δημητριακών, που συνδέονται με μια μεγάλη κατανάλωση ψαριών και EVOO (η τελευταία ως κύρια πηγή λιπών), μειωμένη κατανάλωση κόκκινου κρέατος και γαλακτοκομικών προϊόντων, και μέτρια πρόσληψη αλκοόλης, κυρίως ως κόκκινο κρασί.
Η MD έχει σημαντική επίδραση στη διατήρηση της υγείας και την αύξηση της μακροζωίας, όπως αναφέρεται από τον Εκπαιδευτικό Επιστημονικό και Πολιτιστικό Οργανισμό των Ηνωμένων Εθνών (UNESCO) το 2010 [219, 220].
Κατά τις τελευταίες δεκαετίες, πολυάριθμες επιδημιολογικές μελέτες [221] και μετά-αναλύσεις [222], καθώς και δοκιμές παρέμβασης [223, 224, 225], επιβεβαίωσαν την παρατήρηση αυτή, επισημαίνοντας τον προστατευτικό ρόλο της MD στην πρωτογενή [226] και τη δευτερογενή [227] πρόληψη των καρδιαγγειακών νόσων (Εικ. 5).
Εικ. 5 EVOO and its cardioprotective action on the CV system. EVOO, Extra-virgin olive oil; HT, hydroxytyrosol; OxLDL, oxidized LDL; OS, oxidative stress

Η μελέτη PREDIMING διερεύνησε την προστατευτική επίδραση της MD που συμπληρώθηκε με EVOO ή ξηρούς καρπούς, σε 7477 άτομα που διατρέχουν υψηλό κίνδυνο καρδιαγγειακών παθήσεων, σε μείζονα καρδιαγγειακά (CV) συμβάντα (όπως εγκεφαλικό επεισόδιο, έμφραγμα του μυοκαρδίου ή θάνατο από καρδιαγγειακές αιτίες).
Οι συγγραφείς τόνισαν ότι η συχνότητα εμφάνισης σημαντικών μείζονων καρδιακών συμβάντων μειώθηκε σημαντικά σε άτομα μετά την MD που συμπληρώθηκε με EVOO ή με ξηρούς καρπούς σε σύγκριση με εκείνα που ακολουθούν δίαιτα μειωμένης περιεκτικότητας σε λιπαρά, επιβεβαιώνοντας τις ευεργετικές επιδράσεις της MD για την πρόληψη του πρωτογενούς καρδιαγγειακού συμβάντος[226].
Μια προοπτική τυχαιοποιημένη δοκιμή [227] συνέκρινε μια MD εμπλουτισμένη με άλφα-λινελαϊκό οξύ με μια συνετή διατροφή, όσον αφορά τις αντίστοιχες επιπτώσεις τους στη δευτερογενή πρόληψη μετά από έμφραγμα του μυοκαρδίου, καταλήγοντας στο συμπέρασμα ότι, μια με α-λινελαϊκό οξύ εμπλουτισμένη MD ήταν πιο αποτελεσματική στη δευτερογενή πρόληψη των οξέων στεφανιαίων συμβάντων και του θανάτου, δεδομένου ότι έχει υποτεθεί ότι το λινελαϊκό οξύ μειώνει τη συχνότητα της θανατηφόρου αρρυθμίας [228].
Σε άλλη μελέτη, παρατηρήθηκαν για πρώτη φορά οι επιπτώσεις στην υγεία της ιταλικής μεσογειακής διατροφής (IMD) και της ιταλικής μεσογειακής βιολογικής διατροφής (IMOD) σε υγιή άτομα και σε ασθενείς με χρόνια νεφρική νόσο σταδίου ΙΙ-ΙΙΙ (CKD), που έχουν λάβει χώρα σύμφωνα με τις κατευθυντήριες γραμμές της Πρωτοβουλίας για την Ποιότητα των Αποτελεσμάτων της Νόσου των Νεφρών (K-DOQI) [229].
Συγκεκριμένα, επιδείχθηκε σημαντική μείωση του φωσφόρου, της ολικής ομοκυστεΐνης (Hcy) και της αλβουμινουρίας, καθώς και βελτίωση της σύνθεσης του σώματος (σημαντική αύξηση του ποσοστού άπαχης μάζας και μείωση της λιπώδους μάζας τόσο σε kg όσο και σε ποσοστό) μετά από δύο εβδομάδες θεραπείας με IMOD.
Η βελτίωση όλων αυτών των κλινικών παραμέτρων σχετίζεται με χαμηλότερο κίνδυνο καρδιαγγειακής νόσου, επισημαίνοντας το ρόλο του IMOD στην πρόληψη των καρδιαγγειακών νόσων [224]. Η IMOD φαίνεται να προκαλεί επιβράδυνση της εξέλιξης CKD.
Στη μελέτη αυτή, επιβεβαιώθηκε στη συνέχεια ότι το IMOD σε ασθενείς με CKD σε συντηρητική θεραπεία αποτελεί ένα χρήσιμο εργαλείο για την πρόληψη της καρδιαγγειακής νόσου, προκαλώντας σημαντική μείωση του ορού Hhy, που επηρεάζεται από τον γονότυπο της μεθυλενοτετρατραϋδροφολικής αναγωγάσης (MTHFR) [225]. Η Hcy προκαλεί ενδοθηλιακή δυσλειτουργία μέσω της παραγωγής ROS, η οποία εμφανίζεται κατά τη διάρκεια της διαδικασίας οξείδωσης, επιταχύνοντας έτσι την αθηροσκλήρωση [230, 231].
Το 2011, η Ευρωπαϊκή Αρχή για την Ασφάλεια των Τροφίμων ενέκρινε ορισμένους ισχυρισμούς που αναφέρθηκαν στον κανονισμό αριθ. 432/2012 και αφορά την ωφέλεια που προκύπτει από τα βιοενεργητικά συστατικά που βρίσκονται στα τρόφιμα, συμπεριλαμβανομένων των EVOO φαινολών, ιδίως δε της υδροτυροσόλης και της ελαιοευρωπαΐνης HT και ελαιοευρωπαΐνης, υποστηρίζοντας έτσι τον σημαντικό τους ρόλο στην ανθρώπινη υγεία [232].
Οι επιπτώσεις στην υγεία είναι η προστασία της LDL από οξειδωτική βλάβη, η διατήρηση των φυσιολογικών συγκεντρώσεων της HDL χοληστερόλης στο αίμα, η διατήρηση της φυσιολογικής αρτηριακής πίεσης, οι αντιφλεγμονώδεις ιδιότητες, η συμβολή στην υγεία του ανώτερου αναπνευστικού συστήματος, η διατήρηση της φυσιολογικής λειτουργίας του γαστρεντερικού σωλήνα και η συμβολή στην άμυνα του σώματος ενάντια σε εξωτερικούς παράγοντες. Αυτές οι ευεργετικές επιδράσεις λαμβάνονται με ημερήσια πρόσληψη 20g EVOO, που περιέχει 5 mg HT και τα παράγωγά του [233].
Πράγματι, Η οξειδωμένη LDL (OxLDL) δεσμεύεται από τον υποδοχέα LOX-1 (υποδοχέας OxLDL-lectin-παρόμοια με τον υποδοχέα-1), και διεγείρει την ενδοθηλιακή έκφραση και έκκριση προ-αθηρογόνων ενζύμων.
Αυτός ο δεσμός προκαλεί την παραγωγή υπεροξειδίου και τη μείωση της τοπικής συγκέντρωσης μονοξειδίου του αζώτου (NO). Το LOX-1, το οποίο προκαλεί ταχεία αύξηση των επιπέδων ROS μέσω της μεμβρανικής οξειδάσης NADPH (NOX), είναι ένας ειδικός ενδοθηλιακός υποδοχέας καθαριστής που εμπλέκεται στην αρχική διαδικασία σχηματισμού αθηροσκληρωτικής πλάκας [234].
Τα εκχυλίσματα EVOO δοκιμάστηκαν in vitro σε ανθρώπινα ενδοθηλιακά κύτταρα (HUVEC) για να αξιολογηθεί η αντιοξειδωτική τους ικανότητα [235] και την ικανότητά τους να διαμορφώνουν την κυτταρική έκφραση του ICAM-1 και του VCAM-1 σε ένα προφλεγμονώδες περιβάλλον, προκειμένου να διερευνηθούν οι αντιαθερογόνες επιδράσεις τους [236].
Παρά τις βιολογικές δραστηριότητες των διαιτητικών φαινολικών, έχουν διεξαχθεί μόνο λίγες μελέτες για τη διερεύνηση της απορρόφησής τους στον άνθρωπο μετά την κατάποση. Μια ειδική μελέτη για τα φαινολικά του ελαιολάδου πραγματοποιήθηκε από το Visioli et al. [237], αποδεικνύοντας ότι απορροφήθηκαν στον άνθρωπο και απεκκρίθηκαν στα ούρα ως γλυκουρονίδιο.
Όσον αφορά τις βιολογικές δραστηριότητες του ελαιολάδου, μια ανασκόπηση από την Covas et al. [238] εξέτασε 15 μελέτες σε ανθρώπους και οι περισσότερες δείχνουν ότι το ελαιόλαδο (πλούσιο σε φαινόλες) είναι ανώτερο από τα σπορέλαια και το ελαιόλαδο με χαμηλή περιεκτικότητα σε φαινόλη.
Αυτή η ανωτερότητα αποδόθηκε στη μείωση των παραγόντων κινδύνου CVD, όπως η μειωμένη LDL πλάσματος, η βελτιωμένη ενδοθηλιακή λειτουργία και ένα μειωμένο προθρομβωτικό περιβάλλον.
Πολυφαινολικοί μεταβολίτες του EVOO μετά την κατάποση ήταν μεθυλιωμένοι, σουλφονιμένοι ή γλυκορινωμένοι. Mελέτες in vitro [239, 240] έχουν δείξει ότι αυτές οι μεταβολικές τροποποιήσεις δεν αναστέλλουν τις βιολογικές τους δραστηριότητες στον άνθρωπο.
Επιπλέον, οι μητρικές ενώσεις και οι μεταβολίτες που προέρχονται από το EVOO είναι σε θέση να επιτύχουν συγκέντρωση σε επίπεδο ιστού (κυρίως στα γαστρεντερικά και καρδιαγγειακά συστήματα) ικανά να ασκήσουν αντιοξειδωτικές και αντιφλεγμονώδεις ενέργειες, διαμορφώνοντας την ενδοκυτταρική σηματοδότηση [241].
Οι φαρμακολογικές μελέτες σχετικά με τις δραστηριότητες των φαινολικών ενώσεων αυξάνονται, καθώς φαίνεται να έχουν πιθανές καρδιοπροστατευτικές και χημειοπροληπτικές δράσεις.
Η HT και Ole είναι σε θέση να αναστέλλουν την οξείδωση της LDL που προκαλείται από χαλκό σε χαμηλές συγκεντρώσεις και παρουσιάζουν μια ισχυρή ικανότητα να χηλιώνουν τα μέταλλα και σαρώνουν τις ελεύθερες ρίζες [228, 229].
Ειδικότερα, μια ειδική μελέτη που πραγματοποιήθηκε από την Franconi et al. [242] κατέδειξε ότι η συγκέντρωση Ole που είναι ικανή να μειώσει την LDL που προκαλείται από χαλκό, είναι παρόμοια με εκείνη που μετρήθηκε στο ανθρώπινο πλάσμα μετά την πρόσληψη EVOO [242, 243].
Μια μελέτη σε 10 υγιείς μετεμμηνοπαυσιακές γυναίκες συνέκρινε τις επιδράσεις της υψηλής Ole EVOO (592mg συνολικών φαινολών/kg) με μια χαμηλή Ole EVOO (147 mg συνολικά φαινόλες/kg) και για περίοδο 8 εβδομάδων με ημερήσια δόση του EVOO αξιολογήθηκε η οξειδωτική βλάβη του DNA.
Τα άτομα που έλαβαν υψηλή Ole EVOO είχαν οξειδωτική βλάβη του DNA μειωμένη κατά 30% σε σύγκριση με τα άτομα που έλαβαν θεραπεία με χαμηλή Ole EVOO. Αυτή η μελέτη κατέδειξε έναν προστατευτικό ρόλο των φαινολών EVOO στην οξειδωτική βλάβη σε υγιείς μετεμμηνοπαυσιακές γυναίκες. Επιπλέον, τα άτομα που κατανάλωναν υψηλή σε φαινόλη EVOO είχαν σημαντικά αυξημένη απέκκριση ομοκυστείνης (Ηt) στα ούρα σε σύγκριση με τη χαμηλή φαινόλη EVOO [244].
Τα δεδομένα αυτά επιβεβαιώθηκαν σε μια τυχαιοποιημένη δοκιμή σε 200 υγιή άρρενα άτομα που αξιολόγησαν τις επιδράσεις της περιεκτικότητας σε Ole ελαιολάδου στην οξειδωτική βλάβη των λιπιδίων και στα επίπεδα των λιπιδίων στο πλάσμα. Τα εγγεγραμμένα άτομα τυχαιοποιήθηκαν σε τρεις ομάδες με βάση την περιεκτικότητα σε φαινόλες στο ελαιόλαδο και έλαβαν συγκεκριμένη δόση την ημέρα για συνολικά 3 εβδομάδες.
Οι τρεις τύποι ελαιολάδου ήταν οι εξής: ελαιόλαδο χαμηλής φαινόλης (2,7 mg/kg ελαιολάδου), ελαιόλαδο μέσης φαινόλης (164 mg/kg ελαιολάδου) και ελαιόλαδο υψηλής φαινόλης (666 mg/kg ελαιολάδου). Οι συγγραφείς τόνισαν ότι οι βιοδείκτες του οξειδωτικού στρες μειώθηκαν αναλογικά με την περιεκτικότητα σε φαινόλη, ενώ τα επίπεδα HDL-χοληστερόλης αυξήθηκαν άμεσα στην περιεκτικότητα σε φαινόλη του ελαιολάδου. Τα τριγλυκερίδια μειώθηκαν και στις τρεις ομάδες που εξετάστηκαν.
Ως εκ τούτου, η μελέτη αυτή επιβεβαίωσε ότι η φαινολική περιεκτικότητα βελτιώνει την οξειδωτική βλάβη των λιπιδίων και το προφίλ των λιπιδίων [245]. Αρκετές μελέτες έδειξαν ότι η συνεχής κατανάλωση EVOO σχετίζεται με μείωση των μορίων που εμπλέκονται σε φλεγμονώδεις διεργασίες που σχετίζονται με την αθηροσκλήρωση, με τη μείωση της λειτουργικότητας του NF-kB [246, 247].
Η στενή συσχέτιση μεταξύ φλεγμονής, ενδοθηλιακής δυσλειτουργίας και καρδιαγγειακών νόσων είναι γνωστή [248, 249]. Στη μελέτη που διεξήχθη από Brunelleschi et al. [250], το πλούσιο σε φαινολικές EVOO αναστέλλει, με τρόπο εξαρτώμενο από τη συγκέντρωση, την πυρηνική μετατόπιση των υπομονάδων p50 και p65 του συμπλέγματος NF-κB εντός των μονοκυττάρων και των μακροφάγων που προέρχονται από μονοκύτταρα (MDM) υγιών ατόμων.
Επιπλέον, η OLE, η πιο άφθονη πολυφαινόλη στο EVOO, έχει δείξει ότι αυξάνει σημαντικά την παραγωγή NO που προκαλείται από λιποπολυσακχαρίτη (LPS), έναν βακτηριοκτόνο και κυτταροστατικό παράγοντα του οποίου η αυξημένη έκφραση αυξάνει τη λειτουργική δραστηριότητα των μακροφάγων [251].
Η συχνότητα εμφάνισης χρόνιων ασθενειών που σχετίζονται με τη γήρανση και τον ανθυγιεινό τρόπο ζωής αυξάνεται, αλλά τα αυξανόμενα δεδομένα δείχνουν πώς η πρόσληψη του Ole πλούσιου EVOO μπορεί να βοηθήσει στην πρόληψη ή ακόμη και τη θεραπεία χρόνιων μη μεταδοτικών ασθενειών (ΜΜΑ), στις οποίες το φλεγμονώδες συστατικό εμπλέκεται άμεσα στην έναρξη και την πρόοδό τους [252, 253].
Ένας περιορισμένος αριθμός διαθέσιμων τυχαιοποιημένων ελεγχόμενων δοκιμών (RCTs), δείχνουν τη δράση του EVOO στη δευτερογενή πρόληψη ασθενειών που σχετίζονται με την αθηροσκλήρωση, αλλά δεν υπάρχουν RCTs που να αποσκοπούν στην αξιολόγηση της ελάχιστης ημερήσιας πρόσληψης EVOO που απαιτείται για την αντιμετώπιση αντιφλεγμονώδους και καρδιοπροστατευτικής δράσης [254].
Τα στοιχεία δείχνουν ότι η τακτική κατανάλωση EVOO σχετίζεται με μειωμένο κίνδυνο εμφάνισης ΜΜΑ. Στον τομέα των ΜΜΑ, διαταραχές όπως ο καρκίνος, CKD, αρτηριακή υπέρταση, και μεταβολικό σύνδρομο αξίζουν μια ειδική μνεία [255].
Η μελέτη European Prospective Investigation into Cancer and Nutrition (EPIC) έδειξε την πιθανή συσχέτιση μεταξύ καρκίνου και διατροφής, εξέτασε τον τρόπο ζωής, της διατροφικής κατάστασης, του τύπου διατροφής, του ιατρικού ιστορικού, των ανθρωπομετρικών παραμέτρων και των βιολογικών δειγμάτων. Η μελέτη αυτή διεξήχθη σε 521.000 άτομα (μία από τις μεγαλύτερες μελέτες κοόρτης στον κόσμο) που συμμετείχαν από 23 κέντρα σε 10 χώρες της Δυτικής Ευρώπης.
Μετά την εγγραφή, οι συμμετέχοντες επικοινωνούσαν σε τακτά χρονικά διαστήματα κάθε 3-5 χρόνια (ανάλογα με τη χώρα ή το κέντρο) για να ληφθούν πληροφορίες σχετικά με διάφορες πτυχές του τρόπου ζωής τους, οι οποίες μπορεί να έχουν αλλάξει με την πάροδο του χρόνου. Μέχρι σήμερα, τα δεδομένα που συλλέγονται δείχνουν ότι η MD είναι το πιο αποτελεσματικό μοντέλο τροφίμων στην πρόληψη του καρκίνου. Υπάρχουν επίσης ενδείξεις ότι η κατανάλωση φλαβονοειδών μειώνει τον κίνδυνο γαστρικού καρκίνου [256, 257].
Η ιταλική κοόρτη της μελέτης EPIC, που αποτελείται από 47.749 εθελοντές, αξιολογήθηκε για τις διατροφικές συνήθειες και τον τρόπο ζωής. Οι συγγραφείς κατέληξαν στο συμπέρασμα ότι το πρότυπο τροφίμων «Ελαιόλαδο και Σαλάτα», κυρίως με βάση την κατανάλωση των ωμών λαχανικών, EVOO και όσπρια σχετίζεται με χαμηλότερη θνησιμότητα στους ηλικιωμένους και χαμηλότερο κίνδυνο ανάπτυξης καρκίνου του παχέος εντέρου. Το τελευταίο έχει χαμηλότερη συχνότητα εμφάνισης σε τακτικούς καταναλωτές γιαουρτιού για την πιθανή προστατευτική δράση που ασκείται από τα προβιοτικά κατά των ΜΜΑ [258, 259].
Τα στοιχεία αυτά επιβεβαιώθηκαν σε μια ομάδα 5.611 Ιταλών ηλικιωμένων ατόμων (ηλικίας ≥ 60 ετών), όπου ένα μοντέλο Cox έδειξε ότι η υψηλή κατανάλωση ελαιολάδου, φρέσκων λαχανικών, σούπας και πουλερικών συσχετίστηκε αντιστρόφως με τη θνησιμότητα από όλες τις αιτίες.
Από την άλλη, το σχέδιο τροφίμων «Ζυμαρικά και κρέας» που χαρακτηρίζεται από υψηλή περιεκτικότητα σε ζυμαρικά, σάλτσα ντομάτας, κόκκινο και επεξεργασμένο κρέας, πρόσθετα ζωικά λίπη, λευκό ψωμί και κρασί συσχετίστηκε με αύξηση της θνησιμότητας από όλες τις αιτίες. Οι συγγραφείς συστήνουν υψηλή κατανάλωση ελαιολάδου, νωπών λαχανικών και πουλερικών στον γηριατρική πληθυσμό λόγω των επιπτώσεών της στην υγεία [260].
Στη μελέτη EPICOR (μακροχρόνια παρακολούθηση των αντιθρομβωτικών προτύπων διαχείρισης σε ασθενείς με οξύ στεφανιαίο σύνδρομο), οι συγγραφείς εγγράφηκαν 29.689 Ιταλίδες από βόρειες, κεντρικές και νότιες πόλεις, αξιολογώντας τις πιθανές συσχετίσεις μεταξύ της υπόθεσης του EVOO, των λαχανικών και των φρούτων, και των περιστατικών στεφανιαίας νόσου (CHD). Η μέση περίοδος παρακολούθησης ήταν 7,85 έτη.
Απέδειξαν ότι οι γυναίκες που κατανάλωναν λαχανικά και ελαιόλαδο στο υψηλότερο τεταρτημόριο είχαν μειωμένο κίνδυνο εμφάνισης CHD. Η μελέτη αυτή επιβεβαιώνει την προστατευτική επίδραση των καρδιαγγειακών νόσου στην πρωτογενή και δευτερογενή πρόληψη, που σχετίζεται με την κατανάλωση λαχανικών και ελαιολάδου [261].
4.1 Επιπτώσεις του ελαιόλαδου και των παραγώγων του στη σύνθεση του μικροβιώματος του εντέρου
Ένα από τα πιο πυκνοκατοικημένα ανθρώπινα οικοσυστήματα είναι ο γαστρεντερικός σωλήνας μας. Μπορεί κάλλιστα να υπερηφανεύεται για την παρουσία περίπου 1013 μικροβιακών ειδών μέσα σε αυτό, και ονομάζεται «μικροβίωμα του εντέρου» [262].
Η μελέτη της σχέσης μεταξύ του μικροβιώματος του ανθρώπινου εντέρου και της κατάστασης της υγείας έχει προσελκύσει σημαντικό ενδιαφέρον στην επιστημονική κοινότητα τα τελευταία 15 χρόνια.
Είναι σημαντικό να κατανοήσουμε πώς τα διαφορετικά θρεπτικά συστατικά επηρεάζουν τη σύνθεση του μικροβιώματος του εντέρου, η οποία με τη σειρά της επηρεάζει την εμφάνιση και την εξέλιξη χρόνιων μη μεταδοτικών ασθενειών [263].
Επί του παρόντος, η γνώση σχετικά με το μικροβίωμα του εντέρου δείχνει ότι μπορεί να αλληλοεπιδράσει με τον ξενιστή τόσο άμεσα όσο και έμμεσα. Στην πραγματικότητα, είναι σε θέση να απελευθερώσει βιοδραστικά μόρια που ρυθμίζουν πολυάριθμες βιολογικές απαντήσεις, που περιλαμβάνουν διάφορα συστήματα και λειτουργίες όπως το ανοσοποιητικό σύστημα ή/και την ενεργειακή ομοιόσταση [264].
Ορισμένα θρεπτικά συστατικά μπορούν να επηρεάσουν τη σύνθεση του μικροβιώματος του εντέρου. Μεταξύ αυτών, βρίσκουμε το ελαιόλαδο και τα παράγωγά του [265].
Η Pallara G. et al. [266] αξιολόγησε το προφίλ πολυακόρεστων λιπαρών οξέων (FA) που προέρχεται από ζώα μηρυκαστικών, μετά τη χορήγηση ζωοτροφών που συμπληρώνονται με stoned πυρηνέλαιο (SOP), το οποίο αντιπροσωπεύει απόβλητα που προέρχονται από τις διεργασίες μετατροπής από το ελαιόλαδο.
Κατέληξαν στο συμπέρασμα ότι οι τροφές που συμπληρώθηκαν με SOP μείωσαν την παραγωγή ακόρεστων FA με δοσοεξαρτώμενο τρόπο μέσω της τροποποίησης της σύνθεσης του μικροβιώματος του εντέρου.
Ο N. Martinez et al. [267] πραγματοποίησε μια μελέτη σε ζώα για να συγκρίνει τις επιδράσεις στη σύνθεση του μικροβιώματος του εντέρου των τυποποιημένων διατροφών έναντι των διατροφών υψηλής περιεκτικότητας σε λιπαρά (εμπλουτισμένη με EVOO, εξευγενισμένο ελαιόλαδο ή βούτυρο) δίαιτες. Προκειμένου να αξιολογηθούν οι πιθανές παραλλαγές στο μικροβίωμα του εντέρου που προκαλούνται από διαφορετικές δίαιτες, ανίχνευσαν στα ποντίκια και στα κόπρανα το 16S rRNA.
Η ομάδα που τρέφονται με υψηλή περιεκτικότητα σε λιπαρά διατροφή εμπλουτισμένη με εξευγενισμένο ελαιόλαδο, έδειξε σημαντικά υψηλότερα επίπεδα ολικής χοληστερόλης σε σύγκριση με την ομάδα διατροφής EVOO. Επιπλέον, η διατροφή υψηλής περιεκτικότητας σε λιπαρά εμπλουτισμένη με εξευγενισμένη ομάδα σπορέλαιου έδειξε μεγαλύτερη παρουσία των οικογενειών Desulfovibibrionaceae, Spiroplasmataceae και Helicobacteraceae.
Καθίσταται ολοένα και πιο σαφές ότι οι μικρές πολικές ενώσεις που υπάρχουν στο EVOO είναι σε θέση να διαμορφώσουν θετικά το μικροβίωμα του εντέρου.
Prieto et al. [268] διερεύνησε, στα ελβετικά ποντίκια Webster, τις επιδράσεις (στις ορμονικές, φυσιολογικές, και μεταβολικές παραμέτρους) μιας διατροφής που έχει EVOO ως κύρια πηγή λίπους, σε σύγκριση με μια διατροφή εμπλουτισμένη με βούτυρο.
Επιπλέον, οι συγγραφείς ανέλυσαν DNA κοπράνων και τα 16S rRNA-γονίδια. Στα ποντίκια με δίαιτες βουτύρου, υπήρχαν υψηλότερες τιμές συστολικής αρτηριακής πίεσης και μεγαλύτερο ποσοστό ακολουθιών Desulforibrio σε σύγκριση με τα ποντίκια στη διατροφή EVOO. Επιπλέον, στα ποντίκια με δίαιτα EVOO, οι συγγραφείς παρατήρησαν μειωμένα επίπεδα ινσουλίνης και λεπτίνης στο πλάσμα.
Η συγκέντρωση της λεπτίνης σχετιζόταν αντιστρόφως με το Sutterellaceae, το Marispirillum και το Mucilaginibacter dageonensis. Ως εκ τούτου, η πρόσληψη του EVOO φαίνεται να επηρεάζει τη σύνθεση του εντερικού μικροβιώματος, το οποίο με τη σειρά του μπορεί να επηρεάσει θετικά την κατάσταση της υγείας.
Σε αρουραίους αυθόρμητης υπέρτασης, οι M. Hidalgo et al. [269] διερεύνησαν τις επιδράσεις του EVOO στη σύνθεση του μικροβιώματος του εντέρου και στα επίπεδα αρτηριακής πίεσης. Μετά από 12 εβδομάδες, οι αρουραίοι που τρέφονται με τη διατροφή εμπλουτισμένη με EVOO είχαν σημαντική διαφορά στο ποσοστό Lactobacillus και Clostridia XIV σε σχέση με τους αρουραίους που τρέφονται με τυπική διατροφή. Επιπλέον, η αφθονία του Clostridia XIV σχετιζόταν αντιστρόφως με τις συστολικές τιμές της αρτηριακής πίεσης.
Σε μια τυχαιοποιημένη, διπλή τυφλή διασταυρούμενη ανθρώπινη μελέτη [270] που διεξήχθη σε 10 υπερχοληστερολαιμικά άτομα, οι συγγραφείς αξιολόγησαν τις επιδράσεις της κατανάλωσης συγκεκριμένης ποσότητας ελαιόλαδου την ημέρα για τρεις εβδομάδες στην ανθρώπινη εντερική ανοσολογική λειτουργία.
Οι συγγραφείς μελέτησαν τις επιδράσεις τριών ελαιόλαδων (OO) που διαφέρουν ως προς την περιεκτικότητά τους σε φαινολικές ενώσεις: ποικιλίες OO που περιέχουν 80 mg φαινολικών ενώσεων/kg, OO που περιέχουν 500 mg φαινολικές ενώσεις/kg από OO και OO που περιέχουν μείγμα 500 mg PC/kg από OO και θυμάρι. Οι συγγραφείς κατέληξαν στο συμπέρασμα ότι η κατανάλωση ελαιόλαδου με υψηλή περιεκτικότητα σε φαινολικές ενώσεις προκαλεί αυξημένη διέγερση του εντερικού ανοσοποιητικού συστήματος.
4.2 Οι επιπτώσεις στην υγεία των φαινολικών ενώσεων που υπάρχουν στα εκχυλίσματα φύλλων ελιάς και ελαιοευρωπαΐνης
Τα φύλλα ελιάς, που προέρχονται τόσο από την επεξεργασία των ελιών όσο και από τις πρακτικές κλαδέματος, μπορούν σίγουρα να θεωρηθούν απόβλητα της αλυσίδας του εφοδιασμού της ελιάς.
Αυτοί οι φυτικοί ιστοί είναι μια πολύτιμη πηγή βιοδραστικών ενώσεων, συμπεριλαμβανομένων φαινολών με χαμηλό μοριακό βάρος [97]. Στο φύλλο ελιάς, το προεξέχον συστατικό είναι η ελαιοευρωπαΐνη, η οποία με ενζυμική ή χημική υδρόλυση παράγει την αγλυκονική μορφή που υπάρχει στο έλαιο, την HT, το ελενολικό οξύ και τη γλυκόζη [271, 51].
Σε μια μελέτη του 2016, αναλύθηκαν αρκετά αποσπάσματα από φύλλα ελιάς. Διαπιστώθηκαν ποιοτικές διαφορές στις συνολικές πολυφαινόλες και στην περιεκτικότητα σε ελαιοευρωπαΐνη. Ειδικότερα, οι πολυφαινόλες κυμαίνονταν από 7,87 έως 34,21mg/g, ενώ η Ole κυμαινόταν από 2,79 έως 21,03mg/g ανάλογα με το είδος των φύλλων (νωπά, διατηρημένα με απλή ψύξη, αποξηραμένα, κατεψυγμένα ή λυοφιλοποιημένα), ποικιλία, χρόνο δειγματοληψίας και περιοχή παραγωγής. Η μελέτη αυτή επεσήμανε ότι η Ole και η σταθερότητα σχετίζονται με τη θερμοκρασία εκχύλισης και τη διαδικασία ξήρανσης [272].
Πολλά οφέλη σχετίζονται με τις ιδιότητες και τα χημικά χαρακτηριστικά των φύλλων ελιάς. Για το λόγο αυτό, πολλές μελέτες επικεντρώνονται στη χρήση φύλλων ελιάς για ανθρώπινη κατανάλωση.
Τα τελευταία χρόνια, τα εκχυλίσματα φύλλων ελιάς χρησιμοποιήθηκαν από τη βιομηχανία τροφίμων ως τρόφιμα ή πρόσθετα τροφίμων [98] που παράγουν λειτουργικά τρόφιμα με υγιεινές ιδιότητες. Σε ανασκόπηση του 2017, συγκεντρώθηκαν όλες οι μελέτες που πραγματοποιήθηκαν σχετικά με τα οφέλη των φύλλων ελιάς και των εκχυλισμάτων τους [273].
Μέχρι σήμερα, τα εκχυλίσματα φύλλων ελιάς έχουν πωληθεί ως αποξηραμένα φύλλα, σκόνες, εκχυλίσματα ή δισκία που χρησιμοποιούνται ως αφεψήματα ή συμπληρώματα διατροφής, διαθέσιμα σε όλο τον κόσμο [273].
Τα φύλλα ελιάς επηρεάζουν επίσης το μεταβολισμό, έτσι έχουν χρησιμοποιηθεί στην παραδοσιακή βοτανική ιατρική για χρόνια. Πολλές μελέτες, τόσο in vitro όσο και in vivo, κατέδειξαν τις σημαντικές βιολογικές τους ιδιότητες, συμπεριλαμβανομένων των ραδιοπροστατευτικών, αντι-πολλαπλασιαστικών και κυτταροτοξικών επιδράσεων, αντιμυκητιασική δράση, και αντιθεροσκληρωτικές, υπογλυκαιμικές και καρδιοπροστατευτικές επιδράσεις [273].
Όπως αναφέρθηκε παραπάνω, η ελιά αφήνει την αντιοξειδωτική δράση που της αποδίδεται σε δευτερεύοντες μεταβολίτες, ιδίως στην ελαιοευρωπαΐνη (Ole) και την ικανότητά της να δρα ως ένα χηλικό κατά του Cu και του Fe μεταλλικών ιόντων, τα οποία καταλύουν τις αντιδράσεις παραγωγής ελεύθερων ριζών [274].
Σε υπέρβαρους μεσήλικες άνδρες που διατρέχουν κίνδυνο εμφάνισης διαβήτη, συμπλήρωση με πολυφαινόλες φύλλων ελιάς για 12 εβδομάδες βελτίωσε σημαντικά την ευαισθησία στην ινσουλίνη και την εκκριτική παγκρεατική ικανότητα των β κυττάρων [275].
Οι φαινολικές ενώσεις που προέρχονται από φύλλα ελιάς έχουν δείξει σημαντικές αντιμικροβιακές ιδιότητες, παίζοντας έτσι σημαντικό ρόλο στον έλεγχο της επεξεργασίας και της διατήρησης τροφίμων κατά την αποθήκευση, καθώς και στην εξουδετέρωση παθολογικών μικροοργανισμών όπως το Helicobacter pylori και άλλα παθογόνα που μεταδίδονται από τα τρόφιμα [276].
Ως συνέπεια των αναγνωρισμένων δραστηριοτήτων τους, τα εκχυλίσματα φύλλων ελιάς που περιέχουν πολυφαινόλες μπορούν να χρησιμοποιηθούν ως συστατικά τροφίμων.
Η Ole, και ιδίως ο αγλύκης του που λαμβάνεται με ενζυμική υδρόλυση καθαρών εκχυλισμάτων από φύλλα ελιάς, όπως αναφέρθηκε προηγουμένως [277], έδειξε επίσης μια αντι-αμυλοειδείς επίδραση, με αποτέλεσμα την προστασία από τις κυτταροτοξικές επιδράσεις των αμυλοειδών αδρανών [278, 279], καθώς και έχοντας αποτέλεσμα ως επαγωγέα της αυτοφαγίας με τη διαμόρφωση της οδού AMPK/mTOR και με την ενεργοποίηση της έκφρασης γονιδίων της αυτοφαγίας που μεσολαβούν μέσω των sirtuins ή τον παράγοντα μεταγραφής EB παράγοντας μεταγραφής (βλέπε παραπάνω στο σχετικό κεφάλαιο) [277, 280, 281].
Αυτές οι τελευταίες ενέργειες υποδεικνύουν ότι η Ole μπορεί να έχει νευροπροστατευτική δράση σε ασθένειες όπως η νόσος του Alzheimer, που χαρακτηρίζεται από εναποθέσεις αμυλοειδούς και δυσρύθμιση της αυτοφαγίας, συμβάλλοντας στη μείωση της συσσώρευσης της πρωτεΐνης και στη μείωση της γνωστικής δυσλειτουργίας σε in vivo μοντέλα [282].
Βιβλιογραφία
- Chiara Nediani, Jessica Ruzzolini, Annalisa Romani, and Lido Calorini, Oleuropein, a Bioactive Compound from Ole europaea L., as a Potential Preventive and Therapeutic Agent in Non-Communicable Diseases, Antioxidants (Basel). 2019 Dec; 8(12): 578, doi: 10.3390/antiox8120578.
- World Health Organization . Global Action Plan for the Prevention and Control of Noncommunicable Diseases: 2013–2020. WHO; Geneva, Switzerland: 2013.
- 2. Reddy K.S. Global Burden of Disease Study 2015 provides GPS for global health 2030. Lancet. 2016;388:1448–1449. doi: 10.1016/S0140-6736(16)31743-3.
- Peña-Oyarzun D., Bravo-Sagua R., Diaz-Vega A., Aleman L., Chiong M., Garcia L., Bambs C., Troncoso R., Cifuentes M., Morselli E., et al. Autophagy and oxidative stress in non-communicable diseases: A matter of the inflammatory state? Free Radic. Biol. Med. 2018;124:61–78. doi: 10.1016/j.freeradbiomed.2018.05.084.
- Lavandero S., Chiong M., Rothermel B.A., Hill J.A. Autophagy in cardiovascular biology. J. Clin. Investig. 2015;125:55–64. doi: 10.1172/JCI73943.
- El Assar M., Angulo J., Rodríguez-Mañas L. Oxidative stress and vascular inflammation in aging. Free Radic. Biol. Med. 2013;65:380–401. doi: 10.1016/ j.freeradbiomed.2013.07.003.
- Levine B., Mizushima N., Virgin H.W. Autophagy in immunity and inflammation. Nature. 2011;469:323–335. doi: 10.1038/nature09782.
- Grosso G., Bella F., Godos J., Sciacca S., Del Rio D., Ray S., Galvano F., Giovannucci E.L. Possible role of diet in cancer: Systematic review and multiple meta-analyses of dietary patterns, lifestyle factors, and cancer risk. Nutr. Rev. 2017;75:405–419. doi: 10.1093/nutrit/nux012.
- Grosso G., Godos J., Lamuela-Raventos R., Ray S., Micek A., Pajak A., Sciacca S., D’Orazio N., Del Rio D., Galvano F. A comprehensive meta-analysis on dietary flavonoid and lignan intake and cancer risk: Level of evidence and limitations. Mol. Nutr. Food Res. 2017;61:1600930. doi: 10.1002/mnfr.201600930.
- Grosso G., Micek A., Godos J., Pajak A., Sciacca S., Galvano F., Giovannucci E.L. Dietary Flavonoid and Lignan Intake and Mortality in Prospective Cohort Studies: Systematic Review and Dose-Response Meta-Analysis. Am. J. Epidemiol. 2017;185 :1304–1316. doi: 10.1093/aje/kww207.
- Gaforio J.J., Visioli F., Alarcón-de-la-Lastra C., Castañer O., Delgado-Rodríguez M., Fitó M., Hernández A.F., Huertas J.R., Martínez-González M.A., Menendez J.A., et al. Virgin Olive Oil and Health: Summary of the III International Conference on Virgin Olive Oil and Health Consensus Report, JAEN (Spain) 2018. Nutrients. 2019;11:2039. doi: 10.3390/nu11092039.
- Servili M., Sordini B., Esposto S., Urbani S., Veneziani G., Di Maio I., Selvaggini R., Taticchi A. Biological Activities of Phenolic Compounds of Extra Virgin Olive Oil. Antioxidants. 2013;3:1–23. doi: 10.3390/antiox3010001.
- Waterman E., Lockwood B. Active components and clinical applications of olive oil. Altern. Med. Rev. 2007;12:331–342.
- Casaburi I., Puoci F., Chimento A., Sirianni R., Ruggiero C., Avena P., Pezzi V. Potential of olive oil phenols as chemopreventive and therapeutic agents against cancer: A review of in vitro studies. Mol. Nutr. Food Res. 2013;57:71–83. doi: 10.1002/mnfr.201200503.
- Amiot M.J., Fleuriet A., Macheix J.J. Importance and evolution of phenolic compounds in olive during growth and maturation. J. Agric. Food Chem. 1986;34:823–826. doi: 10.1021/jf00071a014.
- Le Tutour B., Guedon D. Antioxidative activities of Ole europaea leaves and related phenolic compounds. Phytochemistry. 1992;31:1173–1178. doi: 10.1016/0031-9422(92)80255-D.
- Soler-Rivas C., Espín J.C., Wichers H.J. Oleuropein and related compounds. J. Sci. Food Agric. 2000;80:1013–1023. doi: 10.1002/(SICI)1097-0010(20000515)80:7< 1013:AID-JSFA571>3.0.CO;2-C.
- Ryan D., Robards K., Prenzler P., Jardine D., Herlt T., Antolovich M. Liquid chromatography with electrospray ionisation mass spectrometric detection of phenolic compounds from Ole europaea. J. Chromatogr. A. 1999;855:529–537. doi: 10.1016/S0021-9673(99)00719-0.
- Servili M., Esposto S., Fabiani R., Urbani S., Taticchi A., Mariucci F., Selvaggini R., Montedoro G.F. Phenolic compounds in olive oil: Antioxidant, health and organoleptic activities according to their chemical structure. Inflammopharmacology. 2009;17:76–84. doi: 10.1007/s10787-008-8014-y.
- Lozano-Castellón J., López-Yerena A., Rinaldi de Alvarenga J.F., Romero del Castillo-Alba J., Vallverdú-Queralt A., Escribano-Ferrer E., Lamuela-Raventós R.M. Health-promoting properties of oleocanthal and Olecein: Two secoiridoids from extra-virgin olive oil. Crit. Rev. Food Sci. Nutr. 2019:1–17. doi: 10.1080/ 10408398.2019.1650715.
- Beauchamp G.K., Keast R.S.J., Morel D., Lin J., Pika J., Han Q., Lee C.-H., Smith A.B., Breslin P.A.S. Ibuprofen-like activity in extra-virgin olive oil. Nature. 2005;437:45–46. doi: 10.1038/437045a.
- Filipek A., Czerwińska M.E., Kiss A.K., Wrzosek M., Naruszewicz M. Olecein enhances anti-inflammatory activity of human macrophages by increasing CD163 receptor expression. Phytomedicine. 2015;22:1255–1261. doi: 10.1016/j.phymed. 2015.10.005.
- Kanakis P., Termentzi A., Michel T., Gikas E., Halabalaki M., Skaltsounis A.-L. From Olive Drupes to Olive Oil. An HPLC-Orbitrap-based Qualitative and Quantitative Exploration of Olive Key Metabolites. Planta Med. 2013;79:1576–1587. doi: 10.1055/s-0033-1350823.
- EFSA Panel on Dietetic Products. Nutrition and Allergies (NDA) Scientific Opinion on the substantiation of health claims related to polyphenols in olive and protection of LDL particles from oxidative damage (ID 1333, 1638, 1639, 1696, 2865), maintenance of normal blood HDL cholesterol concentrations (ID 1639), mainte: Polyphenols in olive related health claims. EFSA J. 2011;9:2033.
- The European Commission Establishing a list of permitted health claims made on foods, other than those referring to the reduction of disease risk and to children’s development and health—Commission Regulation (EU) No 432/2012. Eur-Lex. 2012;55:1–40.
- Piroddi M., Albini A., Fabiani R., Giovannelli L., Luceri C., Natella F., Rosignoli P., Rossi T., Taticchi A., Servili M., et al. Nutrigenomics of extra-virgin olive oil: A review: Nutrigenomics of extra-virgin olive oil. BioFactors. 2017;43:17–41. doi: 10.1002/biof.1318.
- Romani A., Mulas S., Heimler D. Polyphenols and secoiridoids in raw material (Ole europaea L. leaves) and commercial food supplements. Eur. Food Res. Technol. 2017;243:429–435. doi: 10.1007/s00217-016-2756-3.
- Menendez J.A., Joven J., Aragonès G., Barrajón-Catalán E., Beltrán-Debón R., Borrás-Linares I., Camps J., Corominas-Faja B., Cufí S., Fernández-Arroyo S., et al. Xenohormetic and anti-aging activity of secoiridoid polyphenols present in extra virgin olive oil: A new family of gerosuppressant agents. Cell Cycle. 2013;12:555–578. doi: 10.4161/cc.23756.
- Javed Ahamad, Ibrahim Toufeeq, Mohammad Ahmed Khan, Muath Sh. Mohammed Ameen, Esra T. Anwer, Subha Uthirapathy, Showkat R. Mir, Javed Ahmad, Oleuropein: A natural antioxidant molecule in the treatment of metabolic syndrome
- Migliorini, M., Zanoni, B., Breschi, C., & Mulinacci, N. (2018). An effective HPLC-based approach for the evaluation of the content of total phenolic compounds transferred from olives to virgin olive oil during the olive milling process. Journal of the Science of Food and Agriculture, 98(10), 3636–3643. https://doi.org/10.1002/jsfa.8841 .
- Inouye, H., Yoshida, T., Tobita, S., Tanaka, K., & Nishioka, T. (1970). Absolute struktur des oleuropeins und einiger verwandter glucoside. Tetrahedron Letters, 11, 2459–2464. https://doi.org/10.1016/S0040-4039(01)98255-3.
- Bianco, A., & Uccella, N. (2000). Biophenolic components of olives. Food Research International, 33, 475–485. https://doi.org/10.1016/S0963-9969(00)00072-7
- Amiot, M. J., Fleuriet, A., & Macheix, J. J. (1989). Accumulation of oleuropein derivatives during olive maturation. Phytochemistry, 28,67–69.
- Bastoni, L., Bianco, A., Piccioni, F., & Uccella, N. (2001). Biophenolic profile in olives by nuclear magnetic resonance. Food Chemistry, 73, 145–151. https://doi.org/10.1016/S0308-8146(00)00250-8
- Donaire, J. P., Sanchez, A. J., Lopez-Gorge, J., & Recalde, L. (1975). Metabolic changes in fruit and leaf during ripening in the olive. Phytochemistry, 14, 1167–1169. https://doi.org/10.1016/S0031-9422(00)98588-1
- Damtoft, S., Franzyk, H., & Jensen, S. R. (1992). Excelsioside, a secoiridoid glucoside from Fraxinus excelsior. Phytochemistry, 31, 4197–4201. https://doi.org/10.1016/0031-9422(92)80442-H
- Asaka, Y., Kamikawa, T., Kubota, T., & Sakamoto, H. (1972). Structures of seco-iridoids from Ligstrum obtusifolium Sieb. Et Zucc. Chemistry Letters, 2, 141–144.
- Kuwajima, H., Uemura, T., Takais, K., & lnoue, K, Inouye, H. (1988). A secoiridoid glucoside from Ole europaea. Phytochemistry, 27(6), 1757–1759. https://doi.org/10.1016/0031-9422(88)80438-2
- Gariboldi, P., Jommi, G., & Verotta, L. (1986). Secoiridoids from Ole europaea. Phytochemistry, 25(4), 865–869. https://doi.org/10.1016/0031-9422(86)80018-8
- Panizzi, L., Scarpati, M. L., & Oriente, E. G. (1960). Structure of oleuropein bitter glycoside with hypotensive action of olive oil. Note II. Gazzetta Chimica Italiana, 90, 1449–1485.
- MacKellar, F. A., Kelly, R. C., Van Tamelen, E. E., & Dorschel, C. (1973). Structure and stereochemistry of elenolic acid. Journal of the American Chemical Society, 95, 7155–7156. https://doi.org/10.1021/ja00802a042
- (2001). Isolation and characterization of the antioxidant component 3,4-dihydroxyphenylethyl 4-formyl-3-formylmethyl-4-hexenoate from olive (Ole europaea). Journal of Agriculturaland Food Chemistry, 49, 4214–4219. https://doi.org/10.1021/jf010373z
- Savournin C., Baghdikian B., Elias R., Dargouth-Kesraoui F., Boukef K., Balansard G. Rapid high-performance liquid chromatography analysis for the quantitative determination of oleuropein in Ole europaea leaves. J. Agric. Food Chem. 2001;49:618–621. doi: 10.1021/jf000596+.
- Aponte M., Ungaro F., d’Angelo I., De Caro C., Russo R., Blaiotta G., Dal Piaz F., Calignano A., Miro A. Improving in vivo conversion of oleuropein into hydroxytyrosol by oral granules containing probiotic Lactobacillus plantarum 299v and an Ole europaea standardized extract. Int. J. Pharm. 2018;543:73–82. doi: 10.1016/j.ijpharm.2018.03.013.
- Erbay Z., Icier F. The Importance and Potential Uses of Olive Leaves. Food Rev. Int. 2010;26:319–334. doi: 10.1080/87559129.2010.496021.
- Visioli F., Galli C., Bornet F., Mattei A., Patelli R., Galli G., Caruso D. Olive oil phenolics are dose-dependently absorbed in humans. FEBS Lett. 2000;468:159–160. doi: 10.1016/S0014-5793(00)01216-3.
- Miró-Casas E., Farré Albaladejo M., Covas M.I., Rodriguez J.O., Menoyo Colomer E., Lamuela Raventós R.M., de la Torre R. Capillary gas chromatography-mass spectrometry quantitative determination of hydroxytyrosol and tyrosol in human urine after olive oil intake. Anal. Biochem. 2001;294:63–72. doi: 10.1006/ abio.2001.5160.
- Vissers M.N., Zock P.L., Roodenburg A.J.C., Leenen R., Katan M.B. Olive Oil Phenols Are Absorbed in Humans. J. Nutr. 2002;132:409–417. doi: 10.1093/jn/132.3.409.
- Lemonakis N., Mougios V., Halabalaki M., Skaltsounis A.-L., Gikas E. A novel bioanalytical method based on UHPLC-HRMS/MS for the quantification of oleuropein in human serum. Application to a pharmacokinetic study: Quantification of oleuropein in human serum. Biomed. Chromatogr. 2016;30:2016–2023. doi: 10.1002/bmc.3779.
- de Bock M., Thorstensen E.B., Derraik J.G.B., Henderson H.V., Hofman P.L., Cutfield W.S. Human absorption and metabolism of oleuropein and hydroxytyrosol ingested as olive (Ole europaea L.) leaf extract. Mol. Nutr. Food Res. 2013;57:2079–2085. doi: 10.1002/mnfr.201200795.
- Visioli F., De La Lastra C.A., Andres-Lacueva C., Aviram M., Calhau C., Cassano A., D’Archivio M., Faria A., Favé G., Fogliano V., et al. Polyphenols and human health: A prospectus. Crit. Rev. Food Sci. Nutr. 2011;51:524–546. doi: 10.1080/10408391003698677.
- Hu J., Zou X., He Y., Chen F., Deng Z. Esterification of Quercetin Increases Its Transport Across Human Caco-2 Cells: Synthesize quercetin ester to improve bioavailability… J. Food Sci. 2016;81:H1825–H1832. doi: 10.1111/1750-3841.13366.
- Pagnussatt F.A., de Lima V.R., Dora C.L., Costa J.A.V., Putaux J.-L., Badiale-Furlong E. Assessment of the encapsulation effect of phenolic compounds from Spirulina sp. LEB-18 on their antifusarium activities. Food Chem. 2016;211:616–623. doi: 10.1016/j.foodchem.2016.05.098.
- Žugčić T., Abdelkebir R., Alcantara C., Collado M.C., García-Pérez J.V., Meléndez-Martínez A.J., Režek Jambrak A., Lorenzo J.M., Barba F.J. From extraction of valuable compounds to health promoting benefits of olive leaves through bioaccessibility, bioavailability and impact on gut microbiota. Trends Food Sci. Technol. 2019;83:63–77. doi: 10.1016/j.tifs.2018.11.005.
- Gibis M., Ruedt C., Weiss J. In vitro release of grape-seed polyphenols encapsulated from uncoated and chitosan-coated liposomes. Food Res. Int. 2016;88:105–113. doi: 10.1016/j.foodres.2016.02.010.
- Gleeson J.P., Ryan S.M., Brayden D.J. Oral delivery strategies for nutraceuticals: Delivery vehicles and absorption enhancers. Trends Food Sci. Technol. 2016;53:90–101. doi: 10.1016/j.tifs.2016.05.007.
- Noce A., Marrone G., Di Daniele F., Ottaviani E., Wilson Jones G., Bernini R., Romani A., Rovella V. Impact of Gut Microbiota Composition on Onset and Progression of Chronic Non-Communicable Diseases. Nutrients. 2019;11:1073. doi: 10.3390/nu11051073.
- Mosele J.I., Martín-Peláez S., Macià A., Farràs M., Valls R.-M., Catalán Ú., Motilva M.-J. Faecal microbial metabolism of olive oil phenolic compounds: In vitro and in vivo approaches. Mol. Nutr. Food Res. 2014;58:1809–1819. doi: 10.1002/mnfr.201400124.
- Annalisa Romani, Francesca Ieri,1 Silvia Urciuoli, Annalisa Noce, Giulia Marrone, Chiara Nediani, and Roberta Bernini, Health Effects of Phenolic Compounds Found in Extra-Virgin Olive Oil, By-Products, and Leaf of Ole europaea L., Nutrients. 2019 Aug; 11(8): 1776, doi: 10.3390/nu11081776.
- Visioli F., Galli C., Bornet F., Mattei A., Patelli R., Galli G., Caruso D. Olive oil phenolics are dose-dependently absorbed in humans. FEBS Lett. 2000;468:159–160. doi: 10.1016/S0014-5793(00)01216-3.
- Karkovic Markovic A., Toric J., Barbaric M., Jakobusic Brala C. Hydroxytyrosol, Tyrosol and Derivatives and Their Potential Effects on Human Health. Molecules. 2019;24:2001. doi: 10.3390/molecules24102001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 121. Pastor A., Rodriguez-Morato J., Olesti E., Pujadas M., Perez-Mana C., Khymenets O., Fito M., Covas M.I., Sola R., Motilva M.J., et al. Analysis of free hydroxytyrosol in human plasma following the administration of olive oil. J. Chromatogr. A. 2016;1437:183–190. doi: 10.1016/j.chroma.2016.02.016. [PubMed] [CrossRef] [Google Scholar]
- 122. Jilani H., Cilla A., Barberá R., Hamdi M. Improved bioaccessibility and antioxidant capacity of olive leaf (Ole europaea L.) polyphenols through biosorption on Saccharomyces cerevisiae. Ind. Crops Prod. 2016;84:131–138. doi: 10.1016/j.indcrop.2016.02.002. [CrossRef] [Google Scholar]
- 123. Ahmad-Qasem M.H., Canovas J., Barrajon-Catalan E., Carreres J.E., Micol V., Garcia-Perez J.V. Influence of olive leaf processing on the bioaccessibility of bioactive polyphenols. J. Agric. Food Chem. 2014;62:6190–6198. doi: 10.1021/jf501414h. [PubMed] [CrossRef] [Google Scholar]
- Kendall M., Batterham M., Callahan D.L., Jardine D., Prenzler P., Robards K., Ryan D. Randomized controlled study of the urinary excretion of biophenols following acute and chronic intake of olive leaf supplements. Food Chem. 2012;130:651–659. doi: 10.1016/j.foodchem.2011.07.101. [CrossRef] [Google Scholar]
- 126. Žugčić T., Abdelkebir R., Alcantara C., Collado M.C., García-Pérez J.V., Meléndez-Martínez A., Jambrak A.R., Lorenzo J.M., Barba F.J. From extraction of valuable compounds to health promoting benefits of olive leaves through bioaccessibility, bioavailability and impact on gut microbiota. Trends Food Sci. Technol. 2019;83:63–67. doi: 10.1016/j.tifs.2018.11.005. [CrossRef] [Google Scholar]
- 127. Mosele J.I., Martin-Pelaez S., Macia A., Farras M., Valls R.M., Catalan U., Motilva M.J. Faecal microbial metabolism of olive oil phenolic compounds: In vitro and in vivo approaches. Mol. Nutr. Food Res. 2014;58:1809–1819. doi: 10.1002/mnfr.201400124. [PubMed] [CrossRef] [Google Scholar]
- 128. Santos M.M., Piccirillo C., Castro P.M., Kalogerakis N., Pintado M.E. Bioconversion of oleuropein to hydroxytyrosol by lactic acid bacteria. World J. Microbiol. Biotechnol. 2012;28:2435–2440. doi: 10.1007/s11274-012-1036-z.
- Aponte M., Ungaro F., d’Angelo I., De Caro C., Russo R., Blaiotta G., Dal Piaz F., Calignano A., Miro A. Improving in vivo conversion of oleuropein into hydroxytyrosol by oral granules containing probiotic Lactobacillus plantarum 299v and an Ole europaea standardized extract. Int. J. Pharm. 2018;543:73–82. doi: 10.1016/j.ijpharm.2018.03.013.
- Visioli F., Bellomo G., Galli C. Free Radical-Scavenging Properties of Olive Oil Polyphenols. Biochem. Biophys. Res. Commun. 1998;247:60–64. doi: 10.1006/bbrc.1998.8735. [PubMed] [CrossRef] [Google Scholar]
- Visioli F., Bellomo G., Montedoro G., Galli C. Low density lipoprotein oxidation is inhibited in vitro by olive oil constituents. Atherosclerosis. 1995;117:25–32. doi: 10.1016/0021-9150(95)05546-9.
- Visioli F., Galli C. Oleuropein protects low density lipoprotein from oxidation. Life Sci. 1994;55:1965–1971. doi: 10.1016/0024-3205(94)00529-X.
- Coni E., Di Benedetto R., Di Pasquale M., Masella R., Modesti D., Mattei R., Carlini E.A. Protective effect of oleuropein, an olive oil biophenol, on low density lipoprotein oxidizability in rabbits. Lipids. 2000;35:45–54. doi: 10.1007/s11745-000-0493-2.
- Visioli F., Caruso D., Galli C., Viappiani S., Galli G., Sala A. Olive Oils Rich in Natural Catecholic Phenols Decrease Isoprostane Excretion in Humans. Biochem. Biophys. Res. Commun. 2000;278:797–799. doi: 10.1006/bbrc.2000.3879.
- de la Puerta R., Domínguez M.E.M., Ruíz-Gutíerrez V., Flavill J.A., Hoult J.R.S. Effects of virgin olive oil phenolics on scavenging of reactive nitrogen species and upon nitrergic neurotransmission. Life Sci. 2001;69:1213–1222. doi: 10.1016/ S0024-3205(01)01218-8.
- Manna C., Migliardi V., Golino P., Scognamiglio A., Galletti P., Chiariello M., Zappia V. Oleuropein prevents oxidative myocardial injury induced by ischemia and reperfusion. J. Nutr. Biochem. 2004;15:461–466. doi: 10.1016/j.jnutbio.2003.12.010.
- Parzonko A., Czerwińska M.E., Kiss A.K., Naruszewicz M. Oleuropein and Olecein may restore biological functions of endothelial progenitor cells impaired by angiotensin II via activation of Nrf2/heme oxygenase-1 pathway. Phytomedicine. 2013;20:1088–1094. doi: 10.1016/j.phymed.2013.05.002.
- Al-Azzawie H.F., Alhamdani M.-S.S. Hypoglycemic and antioxidant effect of oleuropein in alloxan-diabetic rabbits. Life Sci. 2006;78:1371–1377. doi: 10.1016/j.lfs.2005.07.029.
- Jemai H., El Feki A., Sayadi S. Antidiabetic and Antioxidant Effects of Hydroxytyrosol and Oleuropein from Olive Leaves in Alloxan-Diabetic Rats. J. Agric. Food Chem. 2009;57:8798–8804. doi: 10.1021/jf901280r.
- Rigacci S., Guidotti V., Bucciantini M., Parri M., Nediani C., Cerbai E., Stefani M., Berti A. Oleuropein aglycon prevents cytotoxic amyloid aggregation of human amylin. J. Nutr. Biochem. 2010;21:726–735. doi: 10.1016/j.jnutbio.2009.04.010.
- Al-Azzawie H.F., Alhamdani M.-S.S. Hypoglycemic and antioxidant effect of oleuropein in alloxan-diabetic rabbits. Life Sci. 2006;78:1371–1377. doi: 10.1016/j.lfs.2005.07.029.
- Eidi A., Eidi M., Darzi R. Antidiabetic effect of Ole europaea L. in normal and diabetic rats. Phytother. Res. 2009;23:347–350. doi: 10.1002/ptr.2629.
- Hadrich F., Garcia M., Maalej A., Moldes M., Isoda H., Feve B., Sayadi S. Oleuropein activated AMPK and induced insulin sensitivity in C2C12 muscle cells. Life Sci. 2016;151:167–173. doi: 10.1016/j.lfs.2016.02.027.
- Carnevale R., Silvestri R., Loffredo L., Novo M., Cammisotto V., Castellani V., Bartimoccia S., Nocella C., Violi F. Oleuropein, a component of extra virgin olive oil, lowers postprandial glycaemia in healthy subjects: Oleuropein lowers postprandial glycaemia in healthy subjects. Br. J. Clin. Pharmacol. 2018;84:1566–1574. doi: 10.1111/bcp.13589.
- de Bock M., Derraik J.G.B., Brennan C.M., Biggs J.B., Morgan P.E., Hodgkinson S.C., Hofman P.L., Cutfield W.S. Olive (Ole europaea L.) Leaf Polyphenols Improve Insulin Sensitivity in Middle-Aged Overweight Men: A Randomized, Placebo-Controlled, Crossover Trial. PLoS ONE. 2013;8:e57622. doi: 10.1371/journal.pone.0057622.
- Wainstein J., Ganz T., Boaz M., Bar Dayan Y., Dolev E., Kerem Z., Madar Z. Olive Leaf Extract as a Hypoglycemic Agent in Both Human Diabetic Subjects and in Rats. J. Med. Food. 2012;15:605–610. doi: 10.1089/jmf.2011.0243.
- Lockyer S., Rowland I., Spencer J.P.E., Yaqoob P., Stonehouse W. Impact of phenolic-rich olive leaf extract on blood pressure, plasma lipids and inflammatory markers: A randomised controlled trial. Eur. J. Nutr. 2017;56:1421–1432. doi: 10.1007/s00394-016-1188-y.
- Alkhateeb H., Al-Duais M., Qnais E. Beneficial effects of oleuropein on glucose uptake and on parameters relevant to the normal homeostatic mechanisms of glucose regulation in rat skeletal muscle. Phytother. Res. 2018;32:651–656. doi: 10.1002/ptr.6012.
- Andreadou I., Iliodromitis E.K., Mikros E., Constantinou M., Agalias A., Magiatis P., Skaltsounis A.L., Kamber E., Tsantili-Kakoulidou A., Kremastinos D.T. The olive constituent oleuropein exhibits anti-ischemic, antioxidative, and hypolipidemic effects in anesthetized rabbits. J. Nutr. 2006;136:2213–2219. doi: 10.1093/jn/ 136.8.2213.
- Hur W., Kim S.W., Lee Y.K., Choi J.E., Hong S.W., Song M.J., Bae S.H., Park T., Um S.-J., Yoon S.K. Oleuropein reduces free fatty acid-induced lipogenesis via lowered extracellular signal-regulated kinase activation in hepatocytes. Nutr. Res. 2012;32:778–786. doi: 10.1016/j.nutres.2012.06.017.
- Domitrović R., Jakovac H., Marchesi V.V., Šain I., Romić Ž., Rahelić D. Preventive and therapeutic effects of oleuropein against carbon tetrachloride-induced liver damage in mice. Pharmacol. Res. 2012;65:451–464. doi: 10.1016/j.phrs.2011.12. 005.
- Kim S.W., Hur W., Li T.Z., Lee Y.K., Choi J.E., Hong S.W., Lyoo K.-S., You C.R., Jung E.S., Jung C.K., et al. Oleuropein prevents the progression of steatohepatitis to hepatic fibrosis induced by a high-fat diet in mice. Exp. Mol. Med. 2014;46:e92. doi: 10.1038/emm.2014.10.
- Park S., Choi Y., Um S.-J., Yoon S.K., Park T. Oleuropein attenuates hepatic steatosis induced by high-fat diet in mice. J. Hepatol. 2011;54:984–993. doi: 10.1016/j.jhep.2010.08.019.
- Lou-Bonafonte J.M., Arnal C., Navarro M.A., Osada J. Efficacy of bioactive compounds from extra virgin olive oil to modulate atherosclerosis development. Mol. Nutr. Food Res. 2012;56:1043–1057. doi: 10.1002/mnfr.201100668.
- Carluccio M.A., Siculella L., Ancora M.A., Massaro M., Scoditti E., Storelli C., Visioli F., Distante A., De Caterina R. Olive Oil and Red Wine Antioxidant Polyphenols Inhibit Endothelial Activation: Antiatherogenic Properties of Mediterranean Diet Phytochemicals. Arterioscler. Thromb. Vasc. Biol. 2003;23:622–629. doi: 10.1161/01.ATV.0000062884.69432.A0.
- Dell’Agli M., Fagnani R., Mitro N., Scurati S., Masciadri M., Mussoni L., Galli G.V., Bosisio E., Crestani M., De Fabiani E., et al. Minor Components of Olive Oil Modulate Proatherogenic Adhesion Molecules Involved in Endothelial Activation. J. Agric. Food Chem. 2006;54:3259–3264. doi: 10.1021/jf0529161.
- Lockyer S., Corona G., Yaqoob P., Spencer J.P.E., Rowland I. Secoiridoids delivered as olive leaf extract induce acute improvements in human vascular function and reduction of an inflammatory cytokine: A randomised, double-blind, placebo-controlled, cross-over trial. Br. J. Nutr. 2015;114:75–83. doi: 10.1017/S0007114515001269.
- Dell’Agli M., Maschi O., Galli G.V., Fagnani R., Dal Cero E., Caruso D., Bosisio E. Inhibition of platelet aggregation by olive oil phenols via cAMP-phosphodiesterase. Br. J. Nutr. 2008;99:945–951. doi: 10.1017/S0007114507 837470.
- Stefani M., Rigacci S. Beneficial properties of natural phenols: Highlight on protection against pathological conditions associated with amyloid aggregation: Phenols Protection Against Amyloid Diseases. BioFactors. 2014;40:482–493. doi: 10.1002/biof.1171.
- Sato S., Hattori N. Dopaminergic Neuron-Specific Autophagy-Deficient Mice. In: Hattori N., Saiki S., editors. Mitophagy. Volume 1759. Springer; New York, NY, USA: 2018. pp. 173–175.
- Komatsu M., Waguri S., Ueno T., Iwata J., Murata S., Tanida I., Ezaki J., Mizushima N., Ohsumi Y., Uchiyama Y., et al. Impairment of starvation-induced and constitutive autophagy in Atg7 -deficient mice. J. Cell Biol. 2005;169:425–434. doi: 10.1083/jcb.200412022.
- Yoshizaki T., Kusunoki C., Kondo M., Yasuda M., Kume S., Morino K., Sekine O., Ugi S., Uzu T., Nishio Y., et al. Autophagy regulates inflammation in adipocytes. Biochem. Biophys. Res. Commun. 2012;417:352–357. doi: 10.1016/j.bbrc.2011 .11.114.
- Yang L., Li P., Fu S., Calay E.S., Hotamisligil G.S. Defective Hepatic Autophagy in Obesity Promotes ER Stress and Causes Insulin Resistance. Cell Metab. 2010;11: 467–478. doi: 10.1016/j.cmet.2010.04.005.
- Park H.-W., Park H., Semple I.A., Jang I., Ro S.-H., Kim M., Cazares V.A., Stuenkel E.L., Kim J.-J., Kim J.S., et al. Pharmacological correction of obesity-induced autophagy arrest using calcium channel blockers. Nat. Commun. 2014;5:4834. doi: 10.1038/ncomms5834.
- Kaushik S., Rodriguez-Navarro J.A., Arias E., Kiffin R., Sahu S., Schwartz G.J., Cuervo A.M., Singh R. Autophagy in Hypothalamic AgRP Neurons Regulates Food Intake and Energy Balance. Cell Metab. 2011;14:173–183. doi: 10.1016/j.cmet.2011.06.008.
- Mir S.U.R., George N.M., Zahoor L., Harms R., Guinn Z., Sarvetnick N.E. Inhibition of Autophagic Turnover in β-Cells by Fatty Acids and Glucose Leads to Apoptotic Cell Death. J. Biol. Chem. 2015;290:6071–6085. doi: 10.1074/jbc.M114.605345.
- Nemchenko A., Chiong M., Turer A., Lavandero S., Hill J.A. Autophagy as a therapeutic target in cardiovascular disease. J. Mol. Cell. Cardiol. 2011;51:584–593. doi: 10.1016/j.yjmcc.2011.06.010.
- Rifki O.F., Hill J.A. Cardiac Autophagy: Good With the Bad. J. Cardiovasc. Pharmacol. 2012;60:248–252. doi: 10.1097/FJC.0b013e3182646cb1.
- Ke P., Shao B.-Z., Xu Z.-Q., Chen X.-W., Liu C. Intestinal Autophagy and Its Pharmacological Control in Inflammatory Bowel Disease. Front. Immunol. 2017;7:695. doi: 10.3389/fimmu.2016.00695.
- Fang L., Li B., Guan J., Xu H., Shen G., Gao Q., Qin Z. Transcription factor EB is involved in autophagy-mediated chemoresistance to doxorubicin in human cancer cells. Acta Pharm. Sin. 2017;38:1305–1316. doi: 10.1038/aps.2017.25.
- de Pablos R.M., Espinosa-Oliva A.M., Hornedo-Ortega R., Cano M., Arguelles S. Hydroxytyrosol protects from aging process via AMPK and autophagy; a review of its effects on cancer, metabolic syndrome, osteoporosis, immune-mediated and neurodegenerative diseases. Pharmacol. Res. 2019;143:58–72. doi: 10.1016 /j.phrs.2019.03.005.
- Rigacci S., Miceli C., Nediani C., Berti A., Cascella R., Pantano D., Nardiello P., Luccarini I., Casamenti F., Stefani M. Oleuropein aglycone induces autophagy via the AMPK/mTOR signalling pathway: A mechanistic insight. Oncotarget. 2015;6:35344–35357. doi: 10.18632/oncotarget.6119.
- Grossi C., Rigacci S., Ambrosini S., Ed Dami T., Luccarini I., Traini C., Failli P., Berti A., Casamenti F., Stefani M. The polyphenol oleuropein aglycone protects TgCRND8 mice against Aß plaque pathology. PLoS ONE. 2013;8:e71702. doi: 10.1371/journal.pone.0071702.
- Miceli C., Santin Y., Manzella N., Coppini R., Berti A., Stefani M., Parini A., Mialet-Perez J., Nediani C. Oleuropein Aglycone Protects against MAO-A-Induced Autophagy Impairment and Cardiomyocyte Death through Activation of TFEB. Oxidative Med. Cell. Longev. 2018;2018:8067592. doi: 10.1155/2018/8067592.
- Manni M.E., Rigacci S., Borchi E., Bargelli V., Miceli C., Giordano C., Raimondi L., Nediani C. Monoamine Oxidase Is Overactivated in Left and Right Ventricles from Ischemic Hearts: An Intriguing Therapeutic Target. Oxidative Med. Cell. Longev. 2016;2016:4375418. doi: 10.1155/2016/4375418.
- Nediani C., Raimondi L., Borchi E., Cerbai E. Nitric Oxide/Reactive Oxygen Species Generation and Nitroso/Redox Imbalance in Heart Failure: From Molecular Mechanisms to Therapeutic Implications. Antioxid. Redox Signal. 2011;14:289–331. doi: 10.1089/ars.2010.3198.
- Santin Y., Sicard P., Vigneron F., Guilbeau-Frugier C., Dutaur M., Lairez O., Couderc B., Manni D., Korolchuk V.I., Lezoualc’h F., et al. Oxidative Stress by Monoamine Oxidase-A Impairs Transcription Factor EB Activation and Autophagosome Clearance, Leading to Cardiomyocyte Necrosis and Heart Failure. Antioxid. Redox Signal. 2016;25:10–27. doi: 10.1089/ars.2015.6522.
- Anderson E.J., Efird J.T., Davies S.W., O’Neal W.T., Darden T.M., Thayne K.A., Katunga L.A., Kindell L.C., Ferguson T.B., Anderson C.A., et al. Monoamine Oxidase is a Major Determinant of Redox Balance in Human Atrial Myocardium and is Associated With Postoperative Atrial Fibrillation. J. Am. Heart Assoc. 2014;3:e000713. doi: 10.1161/JAHA.113.000713.
- Stefani M., Dobson C.M. Protein aggregation and aggregate toxicity: New insights into protein folding, misfolding diseases and biological evolution. J. Mol. Med. 2003;81:678–699. doi: 10.1007/s00109-003-0464-5.
- Chiti F., Dobson C.M. Protein Misfolding, Amyloid Formation, and Human Disease: A Summary of Progress Over the Last Decade. Annu. Rev. Biochem. 2017;86:27–68. doi: 10.1146/annurev-biochem-061516-045115.
- Rigacci S., Stefani M. Nutraceutical Properties of Olive Oil Polyphenols. An Itinerary from Cultured Cells through Animal Models to Humans. Int. J. Mol. Sci. 2016;17:843. doi: 10.3390/ijms17060843.
- Ngoungoure V.L.N., Schluesener J., Moundipa P.F., Schluesener H. Natural polyphenols binding to amyloid: A broad class of compounds to treat different human amyloid diseases. Mol. Nutr. Food Res. 2015;59:8–20. doi: 10.1002/mnfr.201400290.
- Malchiodi-Albedi F., Paradisi S., Matteucci A., Frank C., Diociaiuti M. Amyloid Oligomer Neurotoxicity, Calcium Dysregulation, and Lipid Rafts. Int. J. Alzheimers Dis. 2011;2011:906964. doi: 10.4061/2011/906964.
- Natale G., Pasquali L., Paparelli A., Fornai F. Parallel manifestations of neuropathologies in the enteric and central nervous systems: Neurodegeneration and the gut. Neurogastroenterol. Motil. 2011;23:1056–1065. doi: 10.1111/j.1365-2982.2011.01794.x.
- Dinda B., Dinda M., Kulsi G., Chakraborty A., Dinda S. Therapeutic potentials of plant iridoids in Alzheimer’s and Parkinson’s diseases: A review. Eur. J. Med. Chem. 2019;169:185–199. doi: 10.1016/j.ejmech.2019.03.009.
- Rigacci S., Guidotti V., Bucciantini M., Nichino D., Relini A., Berti A., Stefani M. Aβ(1-42) aggregates into non-toxic amyloid assemblies in the presence of the natural polyphenol oleuropein aglycon. Curr. Alzheimer Res. 2011;8:841–852. doi: 10.2174/156720511798192682. [PubMed] [CrossRef] [Google Scholar]
- 123. Palazzi L., Bruzzone E., Bisello G., Leri M., Stefani M., Bucciantini M., Polverino de Laureto P. Oleuropein aglycone stabilizes the monomeric α-synuclein and favours the growth of non-toxic aggregates. Sci. Rep. 2018;8 doi: 10.1038/s41598-018-26645-5.
- Mohammad-Beigi H., Aliakbari F., Sahin C., Lomax C., Tawfike A., Schafer N.P., Amiri-Nowdijeh A., Eskandari H., Møller I.M., Hosseini-Mazinani M., et al. Oleuropein derivatives from olive fruit extracts reduce α-synuclein fibrillation and oligomer toxicity. J. Biol. Chem. 2019;294:4215–4232. doi: 10.1074/jbc.RA118.005723.
- Diomede L., Rigacci S., Romeo M., Stefani M., Salmona M. Oleuropein aglycone protects transgenic C. elegans strains expressing Aβ42 by reducing plaque load and motor deficit. PLoS ONE. 2013;8:e58893. doi: 10.1371/journal.pone.0058893.
- Luccarini I., Ed Dami T., Grossi C., Rigacci S., Stefani M., Casamenti F. Oleuropein aglycone counteracts Aβ42 toxicity in the rat brain. Neurosci. Lett. 2014;558:67–72. doi: 10.1016/j.neulet.2013.10.062.
- Borchi E., Bargelli V., Guidotti V., Berti A., Stefani M., Nediani C., Rigacci S. Mild exposure of RIN-5F β-cells to human islet amyloid polypeptide aggregates upregulates antioxidant enzymes via NADPH oxidase-RAGE: An hormetic stimulus. Redox Biol. 2014;2:114–122. doi: 10.1016/j.redox.2013.12.005.
- Khemtémourian L., Antoinette Killian J., Höppener J.W.M., Engel M.F.M. Recent Insights in Islet Amyloid Polypeptide-Induced Membrane Disruption and Its Role in β-Cell Death in Type 2 Diabetes Mellitus. Exp. Diabetes Res. 2008;2008:421287. doi: 10.1155/2008/421287.
- Leri M., Nosi D., Natalello A., Porcari R., Ramazzotti M., Chiti F., Bellotti V., Doglia S.M., Stefani M., Bucciantini M. The polyphenol Oleuropein aglycone hinders the growth of toxic transthyretin amyloid assemblies. J. Nutr. Biochem. 2016;30:153–166. doi: 10.1016/j.jnutbio.2015.12.009.
- Leri M., Oropesa-Nuñez R., Canale C., Raimondi S., Giorgetti S., Bruzzone E., Bellotti V., Stefani M., Bucciantini M. Oleuropein aglycone: A polyphenol with different targets against amyloid toxicity. Biochim. Biophys. Acta BBA Gen. Subj. 2018;1862:1432–1442. doi: 10.1016/j.bbagen.2018.03.023.
- Valleix S., Gillmore J.D., Bridoux F., Mangione P.P., Dogan A., Nedelec B., Boimard M., Touchard G., Goujon J.-M., Lacombe C., et al. Hereditary Systemic Amyloidosis Due to Asp76Asn Variant β2-Microglobulin. N. Engl. J. Med. 2012;366:2276–2283. doi: 10.1056/NEJMoa1201356.
- Leri M., Bemporad F., Oropesa-Nuñez R., Canale C., Calamai M., Nosi D., Ramazzotti M., Giorgetti S., Pavone F.S., Bellotti V., et al. Molecular insights into cell toxicity of a novel familial amyloidogenic variant of β2-microglobulin. J. Cell. Mol. Med. 2016;20:1443–1456. doi: 10.1111/jcmm.12833.
- Mangione P.P., Esposito G., Relini A., Raimondi S., Porcari R., Giorgetti S., Corazza A., Fogolari F., Penco A., Goto Y., et al. Structure, Folding Dynamics, and Amyloidogenesis of D76N β2-Microglobulin: ROLES OF SHEAR FLOW, HYDROPHOBIC SURFACES, AND α-CRYSTALLIN. J. Biol. Chem. 2013;288:30917–30930. doi: 10.1074/jbc.M113.498857.
- Knowler, W. C., Barrett-Connor, E., Fowler, S. E., Hamman, R. F., Lachin, J. M., Walker, E. A., … Diabetes Prevention Program Research Group (2002). Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. The New England Journal of Medicine, 346(6), 393–403. https://doi.org/10.1056/ NEJMoa012512
- Tuomilehto, J., Lindstrom, J., Eriksson, J. G., Valle, T. T., Hamalainen, H., Ilanne-Parikka, P., … Salminen, V. (2001). Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. The New England Journal of Medicine, 344(18), 1343–1350. https://doi.org/10.1056/ NEJM200105033441801
- Ashwell, M., Cole, T. J., & Dixon, A. K. (1985). Obesity: New insight into the anthropometric classification of fat distribution shown by computed tomography. BMJ, 290, 1692–1694. https://doi.org/10.1136/bmj.290.6483.1692
- Carr, M. C., & Brunzell, J. D. (2004). Abdominal obesity and dyslipidemia in the metabolic syndrome: Importance of type 2 diabetes and familial combined hyperlipidemia in coronary artery disease risk. Journal of Clinical Endocrinology and Metabolism, 89(6), 2601–2607. https://doi.org/10.1210/jc.2004-0432
- Enzi, G., Gasparo, M., Bindetti, P. R., Fiore, D., Semisa, M., & Zurlo, F. (1986). Subcutaneous and visceral fat distribution according to sex, age, and overweight, evaluated by computed tomography. American Journal of Clinical Nutrition, 44, 739–746. https://doi.org/10.1093/ajcn/44.6.739
- Despres, J. P., Moorjani, S., Ferland, M., Tremblay, A., Lupien, P. J., Nadeau, A., … Bouchard, C. (1989). Adipose tissue distribution and plasma lipoprotein levels in obese women. Importance of intra-abdominal fat. Arteriosclerosis, 9, 203–210. https://doi.org/10.1161/01.ATV.9.2.203
- Fujioka, S., Matsuzawa, Y., Tokunaga, K., & Tarui, S. (1987). Contribution of intra-abdominal fat accumulation to the impairment of glucose and lipid metabolism in human obesity. Metabolism, 36, 54–59. https://doi.org/10.1016/ 0026-0495(87)90063-1
- Poudyal, H., Campbell, F., & Brown, L. (2010). Olive leaf extract attenuates cardiac, hepatic, and metabolic changes in high carbohydrate, high fat fed rats. Journal of Nutrition, 140(5), 946–953. https://doi.org/10.3945/jn.109.117812
- Hadrich, F., Garcia, M., Maalej, A., Moldes, M., Isoda, H., Feve, B., & Sayadi, S. (2016). Oleuropein activated AMPK and induced insulin sensitivity in C2C12 muscle cells. Life Sciences, 151, 167–173. https://doi.org/10.1016/j.lfs.2016.02.027
- Santiago-Mora, R., Casado-Diaz, A., De Castro, M. D., & Quesada-Gomez, J. M. (2011). Oleuropein enhances osteoblastogenesis and inhibits adipogenesis: The effect on differentiation in stem cells derived from bone marrow. Osteoporosis International, 22(2), 675–684. https://doi.org/10.1007/s00198-010-1270-x
- Odegaard, J. I., Ricardo-Gonzalez, R. R., Goforth, M. H., Morel, C. R., Subramanian, V., Mukundan, L., … Chawla, A. (2007). Macrophage specific PPARgamma controls alternative activation and improves insulin resistance. Nature, 447(7148), 1116–1120. https://doi.org/10.1038/nature05894
- Sun, K., Kusminski, C. M., & Scherer, P. E. (2011). Adipose tissue remodeling and obesity. Journal of Clinical Investigation, 121(6), 2094–20101. https://doi.org/10.1172/JCI45887
- Glass, C. K., & Olefsky, J. M. (2012). Inflammation and lipid signaling in the etiology of insulin resistance. Cell Metabolism, 15(5), 635–645. https://doi.org/ 10.1016/j.cmet.2012.04.001
- Drira, R., Chen, S., & Sakamoto, K. (2011). Oleuropein and hydroxytyrosol inhibit adipocyte differentiation in 3 T3-L1 cells. Life Sciences, 89 (19-20), 708–716. https://doi.org/10.1016/j.lfs.2011.08.012
- Lee, H., Lee, Y. J., Choi, H., Ko, E. H., & Kim, J. W. (2009). Reactive oxygen species facilitate adipocyte differentiation by accelerating mitotic clonal expansion. Journal of Biological Chemistry, 284(16), 10601–10609. https://doi.org/10.1074/jbc.M808742200
- Sekiya, M., Hiraishi, A., Touyama, M., & Sakamoto, K. (2008). Oxidative stress induced lipid accumulation via SREBP1c activation in HepG2 cells. Biochemical and Biophysical Research Communications, 375(4), 602–607. https://doi.org/10.1016 /j.bbrc.2008.08.068
- Hadrich, F., Garcia, M., Maalej, A., Moldes, M., Isoda, H., Feve, B., & Sayadi, S. (2016). Oleuropein activated AMPK and induced insulin sensitivity in C2C12 muscle cells. Life Sciences, 151, 167–173. https://doi.org/10.1016/j.lfs.2016.02.027
- Mootoosamy, A., & Mahomoodally, M. F. (2014). Ethnomedicinal application of natives remedies used against diabetes and related complications in Mauritius. Journal of Ethnopharmacology, 151, 413–444. https://doi.org/10.1016/j.jep.2013.10.069
- Khalili, A., Nekooeian, A. A., & Khosravi, M. B. (2017). Oleuropein improves glucose tolerance and lipid profile in rats with simultaneous renovascular hypertension and type 2 diabetes. Journal of Asian Natural Products Research, 19(10), 1011–1021. https://doi.org/10.1080/ 10286020.2017.1307834
- Poudyal, H., Campbell, F., & Brown, L. (2010). Olive leaf extract attenuates cardiac, hepatic, and metabolic changes in high carbohydrate, high fat fed rats. Journal of Nutrition, 140(5), 946–953. https://doi.org/10.3945/jn.109.117812
- Lepore, S. M., Morittu, V. M., Celano, M., Trimboli, F., Oliverio, M., Procopio, A., … Russo, D. (2015). Oral administration of oleuropein and its semisynthetic peracetylated derivative prevents hepatic steatosis, hyperinsulinemia, and weight gain in mice fed with high fat cafeteria diet. International Journal of Endocrinology, 2015, 1–9. https://doi.org/10.1155/ 2015/431453
- Fujiwara, Y., Tsukahara, C., Ikeda, N., Sone, Y., Ishikawa, T., Ichi, I., …Aoki, Y. (2017). Oleuropein improves insulin resistance in skeletal muscle by promoting the translocation of GLUT4. Journal of Clinical Biochemistry and Nutrition, 61(3), 196–202. https://doi.org/ 10.3164 /jcbn.16-120
- Alkhateeb, H., Al-Duais, M., & Qnais, E. (2018). Beneficial effects of oleuropein on glucose uptake and on parameters relevant to the normal homeostatic mechanisms of glucose regulation in rat skeletal muscle. Phytotherapy Research, 32(4), 651–656. https://doi.org/ 10.1002 /ptr.6012
- Carnevale, R., Silvestri, R., Loffredo, L., Novo, M., Cammisotto, V., Castellani, V., … Violi, F. (2018). Oleuropein, a component of extra virgin olive oil, lowers postprandial glycaemia in healthy subjects. British Journal of Clinical Pharmacology, 84(7), 1566–1574. https://doi.org/10.1111/bcp.13589
- Hadrich, F., Mahmoudi, A., Bouallagui, Z., Feki, I., Isoda, H., Feve, B., & Sayadi, S. (2016). Evaluation of hypocholesterolemic effect of oleuropein in cholesterol-fed rats. Chemico-Biological Interactions, 252, 54–60. https://doi.org/10.1016/j.cbi.2016.03.026
- de Bock, M., Derraik, J. G., Brennan, C. M., Biggs, J. B., Morgan, P. E., Hodgkinson, S. C., Hofman PL, CutfieldWS. Olive (Ole europaea L.) leaf polyphenols improve insulin sensitivity in middle-aged overweight men: A randomized, placebo-controlled, crossover trial. Public Library of Science, One 2013; 8(3):e57622: doi: 10.1371/journal.pone.0057622.
- Nordestgaard, B. G. (2016). Triglyceride-rich lipoproteins and atherosclerotic cardiovascular disease: New insights from epidemiology, genetics, and biology. Circulation Research, 118(4), 547–563. https://doi.org/10.1161/CIRCRESAHA.115.306249
- Assmann, G., Cullen, P., & Schulte, H. (1998). The Munster Heart Study (PROCAM): Results of follow-up at 8 years. European Heart Journal, 19 (suppl A), A2–A11.
- Daousi, C., Casson, I. F., Gill, G. V., MacFarlane, I. A., Wilding, J. P., & Pinkney, J. H. (2006). Prevalence of obesity in type 2 diabetes in secondary care: Association with cardiovascular risk factors. Postgraduate Medical Journal, 82(966), 280–284. https://doi.org/10.1136/pmj. 2005.039032
- Haffner, S. M., Lehto, S., Rönnemaa, T., Pyorala, K., & Laakso, M. (1998). Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. New England Journal of Medicine, 339(4), 229–234. https://doi.org/10.1056/NEJM199807233390404
- Juutilainen, A., Lehto, S., Ronnemaa, T., Pyorala, K., & Laakso, M. (2005). Type 2 Diabetes as a «Coronary Heart Disease Equivalent»: An 18-year prospective population-based study in Finnish subjects. Diabetes Care, 28(12), 2901–2907. https://doi.org/10.2337/diacare. 28.12.2901
- Whiteley, L., Padmanabhan, S., Hole, D., & Isles, C. (2005). Should diabetes be considered a coronary heart disease risk equivalent? Results from 25 years of follow-up in the Renfrew and Paisley survey. Diabetes Care, 28(7), 1588–1593. https://doi.org/10.2337/diacare.28.7. 1588
- Kruit, J. K., Kremer, P. H., Dai, L., Tang, R., Ruddle, P., de Haan, W., …Hayden, M. R. (2010). Cholesterol efflux via ATP-binding cassette transporter A1 (ABCA1) and cholesterol uptake via the LDL receptor influences cholesterol-induced impairment of beta cell function in mice. Diabetologia, 53(6), 1110–1119. https://doi.org/10.1007/s00125-010-1691-2
- Zhang, L. L., Yan Liu, D., Ma, L. Q., Luo, Z. D., Cao, T. B., Zhong, J., … Tepel, M. (2007). Activation of transient receptor potential vanilloid type-1 channel prevents adipogenesis and obesity. Circulation Research, 100(7), 1063–1070. https://doi.org/10.1161/01.RES.0002626 53 .84850.8b
- Jakob, T., Nordmann, A. J., Schandelmaier, S., Ferreira-González, I., & Briel, M. (2016). Fibrates for primary prevention of cardiovascular disease events. Cochrane Database of Systematic Reviews, 11, CD009753. https://doi.org/10.1002/ 14651858.cd009753.pub2
- Jakob, T., Nordmann, A. J., Schandelmaier, S., Ferreira-González, I., & Briel, M. (2016). Fibrates for primary prevention of cardiovascular disease events. Cochrane Database of Systematic Reviews, 11, CD009753. https://doi.org/10.1002/ 14651858.cd009753.pub2
- Rafel, R., Marc, C. C., Ruth, M. L., Elisabeth, B., Anna, P., Lia, A. C., et al. (2018). Statins for primary prevention of cardiovascular events and mortality in old and very old adults with and without type 2 diabetes: Retrospective cohort study. British Medical Journal, 362, k3359.
- Rafel, R., Marc, C. C., Ruth, M. L., Elisabeth, B., Anna, P., Lia, A. C., et al. (2018). Statins for primary prevention of cardiovascular events and mortality in old and very old adults with and without type 2 diabetes: Retrospective cohort study. British Medical Journal, 362, k3359.
- Goldbourt, U., Yaari, S., & Medalie, J. H. (1997). Isolated low HDL cholesterol as a risk factor for coronary heart disease mortality: A 21-year follow-up of 8000 men. Arteriosclerosis, Thrombosis, and Vascular Biology, 17, 107–113. https://doi.org/10.1161/01.ATV.17.1.107
- Jemai, H. E., Feki, A., & Sayadi, S. (2009). Antidiabetic and antioxidant effects of hydroxytyrosol and oleuropein from olive leaves in alloxandiabetic rats. Journal of Agriculture and Food Chemistry, 57(19), 8798–8804. https://doi.org/10.1021/jf901280r
- Mahmoudi, A., Hadrich, F., Feki, I., Ghorbel, H., Bouallagui, Z., Marrekchi, R., … Sayadi, S. (2018). Oleuropein and hydroxytyrosol rich extracts from olive leaves attenuate liver injury and lipid metabolism disturbance in bisphenol A-treated rats. Food & Function, 9(6), 3220–3234. https://doi.org/10.1039/C8FO00248G
- Lepore, S. M., Morittu, V. M., Celano, M., Trimboli, F., Oliverio, M., Procopio, A., … Russo, D. (2015). Oral administration of oleuropein and its semisynthetic peracetylated derivative prevents hepatic steatosis, hyperinsulinemia, and weight gain in mice fed with high fat cafeteria diet. International Journal of Endocrinology, 2015, 1–9. https://doi.org/10.1155/2015/431453
- Khalili, A., Nekooeian, A. A., & Khosravi, M. B. (2017). Oleuropein improves glucose tolerance and lipid profile in rats with simultaneous renovascular hypertension and type 2 diabetes. Journal of Asian Natural Products Research, 19(10), 1011–1021. https://doi.org/10.1080/ 10286020.2017.1307834
- Hadrich, F., Garcia, M., Maalej, A., Moldes, M., Isoda, H., Feve, B., & Sayadi, S. (2016). Oleuropein activated AMPK and induced insulin sensitivity in C2C12 muscle cells. Life Sciences, 151, 167–173. https://doi.org/10.1016/j.lfs.2016.02.027
- Andreadou, I., Sigalam, F., Iliodromitis, E. K., Maria, P., Sigalas, C., Aligiannis, N., … Kremastinos, D. T. (2007). Acute doxorubicin cardiotoxicity is successfully treated with the phytochemical oleuropein through suppression of oxidative and nitrosative stress. Journal of Molecular and Cellular Cardiology, 42(3), 549–558.
- Oi-Kano, Y., Kawada, T., Watanabe, T., Koyama, F., Watanabe, K., Senbongi, R., & Iwai, K. (2008). Oleuropein, a phenolic compound in extra virgin olive oil, increases uncoupling protein 1 content in brown adipose tissue and enhances noradrenaline and adrenaline secretions in rats. Journal of Nutritional Science and Vitaminology, 54(5), 363–370. https://doi.org/10.3177/jnsv.54.363
- Malliou, F., Andreadou, I., Gonzalez, F. J., Lazou, A., Xepapadaki, E., & Vallianou, I. (2018). The olive constituent oleuropein, as a PPARα agonist, markedly reduces serum triglycerides. Journal of Nutritional Biochemistry, 59, 17–28. https://doi.org/10.1016/j.jnutbio.2018.05.013
- Gu, L., Okada, Y., Clinton, S. K., Gerard, C., Sukhova, G. K., Libby, P., & Rollins, B. J. (1998). Absence of monocyte chemoattractant protein-1 reduces atherosclerosis in low density lipoprotein receptor-deficient mice. Molecular Cell, 2(2), 275–281. https://doi.org/10.1016 /S1097-2765(00)80139-2
- Li, H., Cybulsky, M. I., Gimbrone, M. A. Jr., & Libby, P. (1993). An atherogenic diet rapidly induces VCAM-1, a cytokine-regulatable mononuclear leukocyte adhesion molecule, in rabbit aortic endothelium. Arteriosclerosis, Thrombosis, and Vascular Biology, 13(2), 197–204. https://doi.org/10.1161/01.ATV.13.2.197
- Cook-Mills, J. M., Marchese, M. E., & Abdala-Valencia, H. (2011). Vascular cell adhesion molecule-1 expression and signaling during disease: Regulation by reactive oxygen species and antioxidants. Antioxidants & Redox Signaling, 15(6), 1607–1638. https://doi.org/10.1089 /ars.2010.3522
- Marui, N., Offermann, M. K., Swerlick, R., Kunsch, C., Rosen, C. A., Ahmad, M., … Medford, R. M. (1993). Vascular cell adhesion molecule-1 (VCAM-1) gene transcription and expression are regulated through an antioxidant-sensitive mechanism in human vascular endothelial cells. Journal of Clinical Investigation, 92(4), 1866–1874. https://doi.org/10.1172/JCI116778
- Lee, Y. W., Kuhn, H., Hennig, B., Neish, A. S., & Toborek, M. (2001). IL-4-induced oxidative stress upregulates VCAM-1 gene expression in human endothelial cells. Journal of Molecular and Cellular Cardiology, 33 (1), 83–94. https://doi.org/10.1006/jmcc.2000.1278
- Salt, I. P., & Palmer, T. M. (2012). Exploiting the anti-inflammatory effects of AMP-activated protein kinase activation. Expert Opinion on Investigational Drugs, 21(8), 1155–1167. https://doi.org/10.1517/13543784.2012.696609
- Fingar, V. H., Taber, S. W., Buschemeyer, W. C., ten Tije, A., Cerrito, P. B., Tseng, M., … Wieman, T. J. (1997). Constitutive and stimulated expression of ICAM-1 protein on pulmonary endothelial cells in vivo. Microvascular Research, 54(2), 135–144.
- Lee, B., Shim, I., Lee, H., & Hahm, D. H. (2018a). Oleuropein reduces anxiety-like responses by activating of serotonergic and neuropeptide Y (NPY)-ergic systems in a rat model of post-traumatic stress disorder. Animal Cells and Systology, 22(2), 109–117. https://doi.org/10. 1080/19768354.2018.1426699
- Mahmoudi, A., Hadrich, F., Feki, I., Ghorbel, H., Bouallagui, Z., Marrekchi, R., … Sayadi, S. (2018). Oleuropein and hydroxytyrosol rich extracts from olive leaves attenuate liver injury and lipid metabolism disturbance in bisphenol A-treated rats. Food & Function, 9(6), 3220–3234. https://doi.org/10.1039/C8FO00248G
- Gao, S., Zhao, D., Wang, M., Zhao, F., Han, X., Qi, Y., & Liu, J. (2017). Association between circulating oxidized LDL and atherosclerotic cardiovascular disease: A meta-analysis of observational studies. Canadian Journal of Cardiology, 3(12), 1624–1632.
- Masella, R., Varì, R., D’Archivio, M., Di Benedetto, R., Matarrese, P., Malorni, W., … Giovannini, C. (2004). Extra virgin olive oil biophenols inhibit cell-mediated oxidation of LDL by increasing the mRNA transcription of glutathione-related enzymes. Journal of Nutrition, 134(4), 785–791. https://doi.org/10.1093/jn/134.4.785
- Hofmann, A., Brunssen, C., & Morawietz, H. (2018). Contribution of lectinlike oxidized low-density lipoprotein receptor-1 and LOX-1 modulating compounds to vascular diseases. Vascular Pharmacology, 107, 1–11. https://doi.org/10.1016/j.vph.2017.10.002
- VanEck, M., Van Dijk, K. W., Herijgers, N., Hofker, M. H., Groot, P. H., & Van Berkel, T. J. (2001). Essential role for the (hepatic) LDL receptor in macrophage apolipoprotein E-induced reduction in serum cholesterol levels and atherosclerosis. Atherosclerosis, 154, 103–112. https://doi.org/10.1016/S0021-9150(00)00471-8
- Jiang, Y., Zhang, J., & Xiong, J. (2007). Ligands of peroxisome proliferatoractivated receptor inhibit homocysteine-induced DNA methylation of inducible nitric oxide synthase gene. Acta Biochimica et Biophysica Sinica, 39, 366–376. https://doi.org/10.1111/j.1745-7270.2007. 00291.x
- Khalili, A., Nekooeian, A. A., & Khosravi, M. B. (2017). Oleuropein improves glucose tolerance and lipid profile in rats with simultaneous renovascular hypertension and type 2 diabetes. Journal of Asian Natural Products Research, 19(10), 1011–1021. https://doi.org/10.1080/ 10286020.2017.1307834
- Nekooeian, A. A., Khalili, A., & Khosravi, M. B. (2014b). Oleuropein offers cardioprotection in rats with simultaneous type 2 diabetes and renal hypertension. Indian Journal of Pharmacology, 46(4), 398–403. https://doi.org/10.4103/0253-7613.135951
- Ivanov, M., Vajic, U. J., Mihailovic-Stanojevic, N., Miloradovic, Z., Jovovic, D., Grujic-Milanovic, J., … Dekanski, D. (2018). Increase blood-flow to brain. Highly potent antioxidant Ole europaea L. leaf extract affects carotid and renal haemodynamics in experimental hypertension: The role of oleuropein. EXCLI Journal, 17, 29–44.
- Vougogiannopoulou, K., Lemus, C., Halabalaki, M., Pergola, C., Werz, O., Smith, A. B., … Deguin, B. (2014). One-step semisynthesis of Olecein and the determination as a 5-lipoxygenase inhibitor. Journal of Natural Products, 77(3), 441–445. https://doi.org/10.1021/ np401010x
- Moreno-Luna, R., Munoz-Hernandez, R., Miranda, M. L., Costa, A. F., Jimenez-Jimenez, L., Vallejo-Vaz, A. J., … Stiefel, P. (2012). Olive oil polyphenols decrease blood pressure and improve endothelial function in young women with mild hypertension. American Journal of Hypertension, 25(12), 1299–1304.
- Carnevale, R., Pignatelli, P., Lenti, L., Buchetti, B., Sanguigni, V., Di Santo, S., & Violi, F. (2007). LDL are oxidatively modified by platelets via GP91(phox) and accumulate in human monocytes. FASEB Journal, 21(3), 927–934. https://doi.org/10.1096/fj.06-6908com
- Lee, B., Shim, I., Lee, H., & Hahm, D. H. (2018b). Effect of oleuropein on cognitive deficits and changes in hippocampal brain-derived neurotrophic factor and cytokine expression in a rat model of post-traumatic stress disorder. Journal of Natural Medicines, 72(1), 44–56. https://doi.org/10.1007/s11418-017-1103-8
- Kohlgruber, A., & Lynch, L. (2015a). Adipose tissue inflammation in the pathogenesis of type 2 diabetes. Current Diabetes Reports, 15(11), 92. https://doi.org/10.1007/s11892-015-0670-x
- Glass, C. K., & Olefsky, J. M. (2012). Inflammation and lipid signaling in the etiology of insulin resistance. Cell Metabolism, 15(5), 635–645. https://doi.org/10.1016/j.cmet.2012.04.001
- de la Puerta, R., Ruiz Gutierrez, V., & Hoult, J. R. (1999). Inhibition of leukocyte 5-lipoxygenase by phenolics from virgin olive oil. Biochemical Pharmacology, 57(4), 445–449. https://doi.org/10.1016/S0006-2952(98)00320-7
- Lockyer, S., Corona, G., Yaqoob, P., Spencer, J. P., & Rowland, I. (2015). Secoiridoids delivered as olive leaf extract induce acute improvements in human vascular function and reduction of an inflammatory cytokine: A randomised, double-blind, placebo-controlled, cross-over trial. British Journal of Nutrition, 114(1), 75–83. https://doi.org/10.1017/ S0007114515001269
- Scoditti, E., Calabriso, N., Massaro, M., Pellegrino, M., Storelli, C., Martines, G., … Carluccio, M. A. (2012). Mediterranean diet polyphenols reduce inflammatory angiogenesis through MMP-9 and COX-2 inhibition in human vascular endothelial cells: A potentially protective mechanism in atherosclerotic vascular disease and cancer. Archives of Biochemistry and Biophysics, 527(2), 81–89. https://doi.org/10.1016/j.abb.2012.05.003
- Kim, Y. H., Choi, Y. J., Kang, M. K., Lee, E. J., Kim, D. Y., Oh, H., & Kang, Y. H. (2018). Oleuropein curtails pulmonary inflammation and tissue destruction in models of experimental asthma and emphysema. Journal of Agriculture and Food Chemistry, 66(29), 7643–7654. https://doi.org/10.1021/acs.jafc.8b01808
- Mahmoudi, A., Hadrich, F., Feki, I., Ghorbel, H., Bouallagui, Z., Marrekchi, R., … Sayadi, S. (2018). Oleuropein and hydroxytyrosol rich extracts from olive leaves attenuate liver injury and lipid metabolism disturbance in bisphenol A-treated rats. Food & Function, 9(6), 3220–3234. https://doi.org/10.1039/C8FO00248G.
- Garcia-Castello E., Cassano A., Criscuoli A., Conidi C., Drioli E. Recovery and concentration of polyphenols from olive mill wastewaters by integrated membrane system. Water Res. 2010;44:3883–3892. doi: 10.1016/j.watres.2010.05.005. [PubMed] [CrossRef] [Google Scholar]
- 12. Cassano A., Conidi C., Giorno L., Drioli E. Fractionation of olive mill wastewaters by membrane separation techniques. J. Hazard. Mater. 2013;248:185–193. doi: 10.1016/j.jhazmat.2013.01.006. [PubMed] [CrossRef] [Google Scholar]
- 13. Romani A., Scardigli A., Pinelli P. An environmentally friendly process for the production of extracts rich in phenolic antioxidants from Ole europaea L. and Cynara scolymus L. matrices. Eur. Food Res. Technol. 2017;243:1229–1238. doi: 10.1007/s00217-016-2835-5. [CrossRef] [Google Scholar]
- 14. Pizzichini D., Russo C., Vitagliano M., Pizzichini M., Romani A., Ieri F., Pinelli P., Vignolini P. Process for producing concentrated and refined actives from tissues and byproducts of Ole europaea with membrane technologies. No. EP2338500A1. Patent. 2011 Jun 29;
- 15. Roig A., Cayuela M.L., Sanchez-Monedero M.A. An overview on olive mill wastes and their valorisation methods. Waste Manag. 2006;26:960–969. doi: 10.1016/j.wasman.2005.07.024. [PubMed] [CrossRef] [Google Scholar]
- Keys A., Menotti A., Karvonen M.J., Aravanis C., Blackburn H., Buzina R., Djordjevic B.S., Dontas A.S., Fidanza F., Keys M.H., et al. The diet and 15-year death rate in the seven countries study. Am. J. Epidemiol. 1986;124:903–915. doi: 10.1093/oxfordjournals.aje.a114480. [PubMed] [CrossRef] [Google Scholar]
- Di Daniele N., Noce A., Vidiri M.F., Moriconi E., Marrone G., Annicchiarico-Petruzzelli M., D’Urso G., Tesauro M., Rovella V., De Lorenzo A. Impact of Mediterranean diet on metabolic syndrome, cancer and longevity. Oncotarget. 2017;8:8947–8979. doi: 10.18632/oncotarget.13553.
- Xavier Medina F. Mediterranean diet, culture and heritage: Challenges for a new conception. Public Health Nutr. 2009;12:1618–1620. doi: 10.1017/S1368980009990450.
- Grosso G., Pajak A., Mistretta A., Marventano S., Raciti T., Buscemi S., Drago F., Scalfi L., Galvano F. Protective role of the Mediterranean diet on several cardiovascular risk factors: Evidence from Sicily, southern Italy. Nutr. Metab. Cardiovasc. Dis. 2014;24:370–377. doi: 10.1016/j.numecd.2013.09.020.
- Grosso G., Marventano S., Yang J., Micek A., Pajak A., Scalfi L., Galvano F., Kales S.N. A comprehensive meta-analysis on evidence of Mediterranean diet and cardiovascular disease: Are individual components equal? Crit. Rev. Food Sci. Nutr. 2017;57:3218–3232. doi: 10.1080/10408398.2015.1107021.
- Di Daniele N., Petramala L., Di Renzo L., Sarlo F., Della Rocca D.G., Rizzo M., Fondacaro V., Iacopino L., Pepine C.J., De Lorenzo A. Body composition changes and cardiometabolic benefits of a balanced Italian Mediterranean Diet in obese patients with metabolic syndrome. Acta Diabetol. 2013;50:409–416. doi: 10.1007/s00592-012-0445-7.
- De Lorenzo A., Noce A., Bigioni M., Calabrese V., Della Rocca D.G., Di Daniele N., Tozzo C., Di Renzo L. The effects of Italian Mediterranean organic diet (IMOD) on health status. Curr. Pharm. Des. 2010;16:814–824. doi: 10.2174/ 138161210790883561.
- Di Daniele N., Di Renzo L., Noce A., Iacopino L., Ferraro P.M., Rizzo M., Sarlo F., Domino E., De Lorenzo A. Effects of Italian Mediterranean organic diet vs. low-protein diet in nephropathic patients according to MTHFR genotypes. J. Nephrol. 2014;27:529–536. doi: 10.1007/s40620-014-0067-y.
- Estruch R., Ros E., Salas-Salvado J., Covas M.I., Corella D., Aros F., Gomez-Gracia E., Ruiz-Gutierrez V., Fiol M., Lapetra J., et al. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. N. Engl. J. Med. 2018;378:e34. doi: 10.1056/NEJMoa1800389.
- De Lorgeril M., Renaud S., Mamelle N., Salen P., Martin J.L., Monjaud I., Guidollet J., Touboul P., Delaye J. Mediterranean alpha-linolenic acid-rich diet in secondary prevention of coronary heart disease. Lancet. 1994;343:1454–1459. doi: 10.1016/S0140-6736(94)92580-1.
- McLennan P.L. Relative effects of dietary saturated, monounsaturated, and polyunsaturated fatty acids on cardiac arrhythmias in rats. Am. J. Clin. Nutr. 1993;57:207–212. doi: 10.1093/ajcn/57.2.207.
- Kopple J.D. National kidney foundation K/DOQI clinical practice guidelines for nutrition in chronic renal failure. Am. J. Kidney Dis. 2001;37:S66–S70. doi: 10.1053/ajkd.2001.20748.
- Zhang X., Li H., Jin H., Ebin Z., Brodsky S., Goligorsky M.S. Effects of homocysteine on endothelial nitric oxide production. Am. J. Physiol. Renal. Physiol. 2000;279:F671–F678. doi: 10.1152/ajprenal.2000.279.4.F671.
- Pastore A., Noce A., Di Giovamberardino G., De Stefano A., Calla C., Zenobi R., Dessi M., Di Daniele N. Homocysteine, cysteine, folate and vitamin B(1)(2) status in type 2 diabetic patients with chronic kidney disease. J. Nephrol. 2015;28:571–576. doi: 10.1007/s40620-014-0126-4.
- EFSA Panel on Dietetic Products. EFSA J. 2011;9:2033–2058.
- EFSA Scientific Opinion on the substantiation of health claims related to polyphenols in olive and protection of LDL particles from oxidative damage (ID 1333, 1638, 1639, 1696, 2865), maintenance of normal blood HDL cholesterol concentrations (ID 1639), maintenance of normal blood pressure (ID 3781), “anti-inflammatory properties” (ID 1882), “contributes to the upper respiratory tract health” (ID 3468), “can help to maintain a normal function of gastrointestinal tract” (3779), and “contributes to body defences against external agents” (ID 3467) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. [(accessed on 5 April 2019)]; Available online: https://www.efsa.europa.eu/en/efsajournal/ pub/2033.
- Dunn S., Vohra R.S., Murphy J.E., Homer-Vanniasinkam S., Walker J.H., Ponnambalam S. The lectin-like oxidized low-density-lipoprotein receptor: A pro-inflammatory factor in vascular disease. Biochem. J. 2008;409:349–355. doi: 10.1042/BJ20071196.
- Zambonin L., Caliceti C., Vieceli Dalla Sega F., Fiorentini D., Hrelia S., Landi L., Prata C. Dietary phenolic acids act as effective antioxidants in membrane models and in cultured cells, exhibiting proapoptotic effects in leukaemia cells. Oxidative Med. Cell. Longev. 2012;2012 doi: 10.1155/2012/839298.
- Dell’Agli M., Fagnani R., Mitro N., Scurati S., Masciadri M., Mussoni L., Galli G.V., Bosisio E., Crestani M., De Fabiani E., et al. Minor components of olive oil modulate proatherogenic adhesion molecules involved in endothelial activation. J. Agric. Food Chem. 2006;54:3259–3264. doi: 10.1021/jf0529161.
- Visioli F., Galli C., Bornet F., Mattei A., Patelli R., Galli G., Caruso D. Olive oil phenolics are dose-dependently absorbed in humans. FEBS Lett. 2000;468:159–160. doi: 10.1016/S0014-5793(00)01216-3.
- Covas M.I. Olive oil and the cardiovascular system. Pharmacol. Res. 2007;55:175–186. doi: 10.1016/j.phrs.2007.01.010.
- Cicerale S., Lucas L.J., Keast R.S. Antimicrobial, antioxidant and anti-inflammatory phenolic activities in extra virgin olive oil. Curr. Opin. Biotechnol. 2012;23:129–135. doi: 10.1016/j.copbio.2011.09.006.
- Incani A., Serra G., Atzeri A., Melis M.P., Serreli G., Bandino G., Sedda P., Campus M., Tuberoso C.I., Deiana M. Extra virgin olive oil phenolic extracts counteract the pro-oxidant effect of dietary oxidized lipids in human intestinal cells. Food Chem. Toxicol. 2016;90:171–180. doi: 10.1016/j.fct.2016.02.015.
- Serreli G., Deiana M. Biological Relevance of Extra Virgin Olive Oil Polyphenols Metabolites. Antioxidants. 2018;7:170. doi: 10.3390/antiox7120170.
- Franconi F., Coinu R., Carta S., Urgeghe P.P., Ieri F., Mulinacci N., Romani A. Antioxidant effect of two virgin olive oils depends on the concentration and composition of minor polar compounds. J. Agric. Food Chem. 2006;54:3121–3125. doi: 10.1021/jf053003+.
- Manna C., D’Angelo S., Migliardi V., Loffredi E., Mazzoni O., Morrica P., Galletti P., Zappia V. Protective effect of the phenolic fraction from virgin olive oils against oxidative stress in human cells. J. Agric. Food Chem. 2002;50:6521–6526. doi: 10.1021/jf020565+.
- Salvini S., Sera F., Caruso D., Giovannelli L., Visioli F., Saieva C., Masala G., Ceroti M., Giovacchini V., Pitozzi V., et al. Daily consumption of a high-phenol extra-virgin olive oil reduces oxidative DNA damage in postmenopausal women. Br. J. Nutr. 2006;95:742–751. doi: 10.1079/BJN20051674.
- Covas M.I., Nyyssonen K., Poulsen H.E., Kaikkonen J., Zunft H.J., Kiesewetter H., Gaddi A., de la Torre R., Mursu J., Baumler H., et al. The effect of polyphenols in olive oil on heart disease risk factors: A randomized trial. Ann. Int. Med. 2006;145:333–341. doi: 10.7326/0003-4819-145-5-200609050-00006.
- Perez-Herrera A., Delgado-Lista J., Torres-Sanchez L.A., Rangel-Zuniga O.A., Camargo A., Moreno-Navarrete J.M., Garcia-Olid B., Quintana-Navarro G.M., Alcala-Diaz J.F., Munoz-Lopez C., et al. The postprandial inflammatory response after ingestion of heated oils in obese persons is reduced by the presence of phenol compounds. Mol. Nutr. Food Res. 2012;56:510–514. doi: 10.1002/ mnfr.201100533.
- Souza P.A.L., Marcadenti A., Portal V.L. Effects of Olive Oil Phenolic Compounds on Inflammation in the Prevention and Treatment of Coronary Artery Disease. Nutrients. 2017;9:1087. doi: 10.3390/nu9101087.
- Tousoulis D., Charakida M., Stefanadis C. Endothelial function and inflammation in coronary artery disease. Heart. 2006;92:441–444. doi: 10.1136/hrt.2005.066936.
- Widmer R.J., Lerman A. Endothelial dysfunction and cardiovascular disease. Glob. Cardiol. Sci. Pract. 2014;2014:291–308. doi: 10.5339/gcsp.2014.43.
- Brunelleschi S., Bardelli C., Amoruso A., Gunella G., Ieri F., Romani A., Malorni W., Franconi F. Minor polar compounds extra-virgin olive oil extract (MPC-OOE) inhibits NF-kappa B translocation in human monocyte/macrophages. Pharmacol. Res. 2007;56:542–549. doi: 10.1016/j.phrs.2007.10.001.
- Visioli F., Galli C. Olive Oil Phenols and Their Potential Effects on Human Health. J. Agric. Food Chem. 1998;10:4292–4296. doi: 10.1021/jf980049c.
- De Lorenzo A., Noce A., Moriconi E., Rampello T., Marrone G., Di Daniele N., Rovella V. MOSH Syndrome (Male Obesity Secondary Hypogonadism): Clinical Assessment and Possible Therapeutic Approaches. Nutrients. 2018;10:474. doi: 10.3390/nu10040474.
- Francisco V., Ruiz-Fernandez C., Lahera V., Lago F., Pino J., Skaltsounis L., Gonzalez-Gay M.A., Mobasheri A., Gomez R., Scotece M., et al. Natural Molecules for Healthy Lifestyles: Oleocanthal from Extra Virgin Olive Oil. J. Agric. Food Chem. 2019;67:3845–3853. doi: 10.1021/acs.jafc.8b06723.
- Wongwarawipat T., Papageorgiou N., Bertsias D., Siasos G., Tousoulis D. Olive Oil-related Anti-inflammatory Effects on Atherosclerosis: Potential Clinical Implications. Endocr. Metab. Immune Disord. Drug Targets. 2018;18:51–62. doi: 10.2174/1871530317666171116103618.
- Santangelo C., Vari R., Scazzocchio B., De Sanctis P., Giovannini C., D’Archivio M., Masella R. Anti-inflammatory Activity of Extra Virgin Olive Oil Polyphenols: Which Role in the Prevention and Treatment of Immune-Mediated Inflammatory Diseases? Endocr. Metab. Immune Disord. Drug Targets. 2018;18:36–50. doi: 10.2174/1871530317666171114114321.
- Riboli E., Hunt K.J., Slimani N., Ferrari P., Norat T., Fahey M., Charrondiere U.R., Hemon B., Casagrande C., Vignat J., et al. European Prospective Investigation into Cancer and Nutrition (EPIC): Study populations and data collection. Public Health Nutr. 2002;5:1113–1124. doi: 10.1079/PHN2002394.
- Park J.Y., Nicolas G., Freisling H., Biessy C., Scalbert A., Romieu I., Chajes V., Chuang S.C., Ericson U., Wallstrom P., et al. Comparison of standardised dietary folate intake across ten countries participating in the European Prospective Investigation into Cancer and Nutrition. Br. J. Nutr. 2012;108:552–569. doi: 10.1017/S0007114511005733.
- Sieri S., Agnoli C., Pala V., Mattiello A., Panico S., Masala G., Assedi M., Tumino R., Frasca G., Sacerdote C., et al. Dietary habits and cancer: The experience of epic-Italy. Epidemiologia e Prevenzione. 2015;39:333–338.
- Noce A., Marrone G., Di Daniele F., Ottaviani E., Wilson Jones G., Bernini R., Romani A., Rovella V. Impact of Gut Microbiota Composition on Onset and Progression of Chronic Non-Communicable Diseases. Nutrients. 2019;11:1073. doi: 10.3390/nu11051073.
- Masala G., Ceroti M., Pala V., Krogh V., Vineis P., Sacerdote C., Saieva C., Salvini S., Sieri S., Berrino F., et al. A dietary pattern rich in olive oil and raw vegetables is associated with lower mortality in Italian elderly subjects. Br. J. Nutr. 2007;98:406–415. doi: 10.1017/S0007114507704981.
- Bendinelli B., Masala G., Saieva C., Salvini S., Calonico C., Sacerdote C., Agnoli C., Grioni S., Frasca G., Mattiello A., et al. Fruit, vegetables, and olive oil and risk of coronary heart disease in Italian women: The EPICOR Study. Am. J. Clin. Nutr. 2011;93:275–283. doi: 10.3945/ajcn.110.000521.
- Mills S., Stanton C., Lane J.A., Smith G.J., Ross R.P. Precision Nutrition and the Microbiome, Part I: Current State of the Science. Nutrients. 2019;11:923. doi: 10.3390/nu11040923.
- Sender R., Fuchs S., Milo R. Are We Really Vastly Outnumbered? Revisiting the Ratio of Bacterial to Host Cells in Humans. Cell. 2016;164:337–340. doi: 10.1016/j.cell.2016.01.013.
- Cani P.D. Human gut microbiome: Hopes, threats and promises. Gut. 2018;67:1716–1725. doi: 10.1136/gutjnl-2018-316723.
- Gavahian M., Khaneghah A.M., Lorenzo J.M., Munekata P.E., Garcia-Mantrana I., Carmen Collado M., Melendez-Martinez A.J., Barba F.J. Health benefits of olive oil and its components: Impacts on gut microbiota antioxidant activities, and prevention of noncommunicable diseases. Trends Food Sci. Technol. 2019 doi: 10.1016/j.tifs.2019.03.008.
- Pallara G., Buccioni A., Pastorelli R., Minieri S., Mele M., Rapaccini S., Messini A., Pauselli M., Servili M., Giovannetti L., et al. Effect of stoned olive pomace on rumen microbial communities and polyunsaturated fatty acid biohydrogenation: An in vitro study. BMC Vet. Res. 2014;10 doi: 10.1186/s12917-014-0271-y.
- Martinez N., Prieto I., Hidalgo M., Segarra A.B., Martinez-Rodriguez A.M., Cobo A., Ramirez M., Galvez A., Martinez-Canamero M. Refined versus Extra Virgin Olive Oil High-Fat Diet Impact on Intestinal Microbiota of Mice and Its Relation to Different Physiological Variables. Microorganisms. 2019;7:61. doi: 10.3390/microorganisms7020061.
- Prieto I., Hidalgo M., Segarra A.B., Martinez-Rodriguez A.M., Cobo A., Ramirez M., Abriouel H., Galvez A., Martinez-Canamero M. Influence of a diet enriched with virgin olive oil or butter on mouse gut microbiota and its correlation to physiological and biochemical parameters related to metabolic syndrome. PLoS ONE. 2018;13:e0190368. doi: 10.1371/journal.pone.0190368.
- Hidalgo M., Prieto I., Abriouel H., Villarejo A.B., Ramirez-Sanchez M., Cobo A., Benomar N., Galvez A., Martinez-Canamero M. Changes in Gut Microbiota Linked to a Reduction in Systolic Blood Pressure in Spontaneously Hypertensive Rats Fed an Extra Virgin Olive Oil-Enriched Diet. Plant Foods Hum. Nutr. 2018;73 doi: 10.1007/s11130-017-0650-1.
- Martin-Pelaez S., Castaner O., Sola R., Motilva M.J., Castell M., Perez-Cano F.J., Fito M. Influence of Phenol-Enriched Olive Oils on Human Intestinal Immune Function. Nutrients. 2016;8:213. doi: 10.3390/nu8040213.
- Gambacorta A., Tofani D., Bernini R., Migliorini A. High-yielding preparation of a stable precursor of hydroxytyrosol by total synthesis and from the natural glycoside oleuropein. J. Agric. Food Chem. 2007;55:3386–3391. doi: 10.1021/jf063353b.
- Romani A., Pinelli P., Ieri F., Bernini R. Sustainability, Innovation, and Green Chemistry in the Production and Valorization of Phenolic Extracts from Ole europaea L. Sustainability. 2016;8:1002. doi: 10.3390/su8101002.
- Özcan M.M., Matthäus B. A review: Benefit and bioactive properties of olive (Ole europaea L.) leaves. Eur. Food Res. Technol. 2017 doi: 10.1007/s00217-016-2726-9.
- Andrikopoulos N.K., Kaliora A.C., Assimopoulou A.N., Papageorgiou V.P. Inhibitory activity of minor polyphenolic and nonpolyphenolic constituents of olive oil against in vitro low-density lipoprotein oxidation. J. Med. Food. 2002;5 doi: 10.1089/109662002753723160.
- De Bock M., Derraik J.G., Brennan C.M., Biggs J.B., Morgan P.E., Hodgkinson S.C., Hofman P.L., Cutfield W.S. Olive (Ole europaea L.) leaf polyphenols improve insulin sensitivity in middle-aged overweight men: A randomized, placebo-controlled, crossover trial. PLoS ONE. 2013;8:e57622. doi: 10.1371/journal.pone. 0057622.
- Sudjana A.N., D’Orazio C., Ryan V., Rasool N., Ng J., Islam N., Riley T.V., Hammer K.A. Antimicrobial activity of commercial Ole europaea (olive) leaf extract. Int. J. Antimicrob. Agents. 2009;33:461–463. doi: 10.1016/j.ijantimicag.2008.10.026.
- Miceli C., Santin Y., Manzella N., Coppini R., Berti A., Stefani M., Parini A., Mialet-Perez J., Nediani C. Oleuropein Aglycone Protects against MAO-A-Induced Autophagy Impairment and Cardiomyocyte Death through Activation of TFEB. Oxid. Med. Cell. Longev. 2018;2018 doi: 10.1155/2018/8067592.
- Rigacci S., Guidotti V., Bucciantini M., Parri M., Nediani C., Cerbai E., Stefani M., Berti A. Oleuropein aglycon prevents cytotoxic amyloid aggregation of human amylin. J. Nutr. Biochem. 2010;21:726–735. doi: 10.1016/j.jnutbio.2009.04.010.
- Rigacci S., Guidotti V., Bucciantini M., Nichino D., Relini A., Berti A., Stefani M. Abeta(1-42) aggregates into non-toxic amyloid assemblies in the presence of the natural polyphenol oleuropein aglycon. Curr. Alzheimer Res. 2011;8:841–852. doi: 10.2174/156720511798192682.
- Rigacci S., Miceli C., Nediani C., Berti A., Cascella R., Pantano D., Nardiello P., Luccarini I., Casamenti F., Stefani M. Oleuropein aglycone induces autophagy via the AMPK/mTOR signalling pathway: A mechanistic insight. Oncotarget. 2015;6:35344–35357. doi: 10.18632/oncotarget.6119.
- Luccarini I., Pantano D., Nardiello P., Cavone L., Lapucci A., Miceli C., Nediani C., Berti A., Stefani M., Casamenti F. The Polyphenol Oleuropein Aglycone Modulates the PARP1-SIRT1 Interplay: An In Vitro and In Vivo Study. J. Alzheimers Dis. 2016;54:737–750. doi: 10.3233/JAD-160471.
- Cordero J.G., Garcia-Escudero R., Avila J., Gargini R., Garcia-Escudero V. Benefit of Oleuropein Aglycone for Alzheimer’s Disease by Promoting Autophagy. Oxid. Med. Cell. Longev. 2018;2018 doi: 10.1155/2018/5010741.



